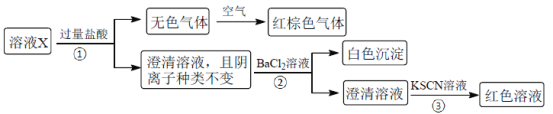
题目内容
【题目】KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸lh;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?__
(2)为什么不用普通滤纸过滤器过滤?___
(3)如何保证在70℃~80℃条件下进行滴定操作:___
(4)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是__
A.H2C2O4·2H2O B.FeSO4·7H2O C.浓盐酸 D.Na2SO3
(5)若准确称取Wg草酸晶体(H2C2O4·2H2O)溶于水配成500mL水溶液,取25.00mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。6H++2MnO4-+5H2C2O4·2H2O=2Mn2++10CO2↑+18H2O,问:
①滴定时,高锰酸钾溶液应装在__;
②滴定终点标志是___;
③KMnO4溶液的物质的量浓度为___;
④若滴定前平视,滴定后俯视,则测得的浓度值将__(填“偏高”或偏低)
【答案】有部分KMnO4被还原成MnO(OH)2 KMnO4的强氧化性能氧化滤纸 可在水浴中加热 A 酸式滴定管 当最后滴下1滴KMnO4溶液后半分钟不褪色时 ![]() 偏高
偏高
【解析】
(1)高锰酸钾易被还原;
(2)高猛酸钾具有强氧化性;
(3)水浴加热温度较低;
(4)基准试剂要求是纯度高、稳定性好的物质;
(5)①滴定时,酸性溶液要盛放在酸式滴定管中;
②滴定终点时最后滴下1滴KMnO4溶液后半分钟不褪色;
③先计算草酸的物质的量浓度,再根据草酸和高锰酸钾之间的关系式计算高锰酸钾的物质的量浓度;
④根据![]() 分析。
分析。
(1)根据题意知,高锰酸钾易被空气中某些还原性物质含有生成MnO(OH)2,所以要要称取稍多于所需的KMnO4固体,故答案为:有部分KMO4被还原成MnO(OH)2;
(2)KMnO4的强氧化性能氧化滤纸;
(3)直接加热温度较高,可用水浴加热,以使温度控制在70℃~80℃,故答案为:可在水浴中加热;
(4)A.H2C2O42H2O溶于水后纯度高、稳定性好,符合要求,故A正确;
B.FeSO47H2O不稳定易被氧气氧化,故B错误;
C.浓盐酸不稳定,易挥发,故C错误;
D.Na2SO3具有还原性,易被氧化而变质,故D错误;
故选A;
(5)①滴定时,高锰酸钾溶液中加入了稀硫酸而使溶液呈酸性,酸性溶液要盛放在酸式滴定管中,故答案为:酸式滴定管;
②当最后滴下1滴KMnO4溶液后半分钟不褪色时,说明滴定到达终点,故答案为:最后滴下1滴KMnO4溶液后半分钟不褪色;
③草酸的物质的量浓度=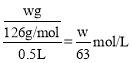 ,由反应可知高锰酸钾与草酸的物质的量之比为2:5,则有
,由反应可知高锰酸钾与草酸的物质的量之比为2:5,则有![]() =
=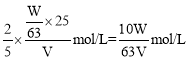 ;
;
④若滴定前平视,滴定后俯视,导致V(待测)偏小,则c(待测)偏高,故答案为:偏高。

【题目】已知反应:4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),一定条件下测得反应过程中n(Cl2)与时间的关系如表所示:则4~6min内用O2的物质的量变化表示的反应速率是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(Cl2)/mol | 0 | 1.2 | 2.6 | 4.4 | 5.4 | 6.0 |
A.7.2molmin-1B.8.0molmin-1C.0.9molmin-1D.0.45molmin-1