题目内容
【题目】某工厂用NaCl为原料制备高氯酸,实验按流程如下所示:
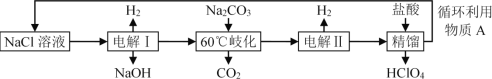
下列说法不正确的是( )
A.电解Ⅰ分别用不锈钢网和石墨作电极,石墨电极上有黄绿色气体生成
B.“60℃歧化”的反应为:3Cl2+3CO32-=5Cl+ClO3-+3CO2
C.电解Ⅱ中阳极反应式为:ClO3-+2OH-2e=ClO4-+H2O
D.循环利用物质A的成分是NaCl、NaClO4
【答案】C
【解析】
A.根据流程图,电解Ⅰ分别用不锈钢网和石墨作电极,电解氯化钠溶液,制备氯气,所以需要用石墨为阳极,故A正确;
B. “60℃歧化”的反应为氯气和碳酸钠反应生成氯化钠、氯酸钠和二氧化碳,反应离子方程式为3Cl2+3CO32-=5Cl+ClO3-+3CO2,故B正确;
C.电解Ⅱ中阳极反应式为:ClO3-+H2O-2e=ClO4-+2H+,故C错误;
D. 根据流程图,循环利用物质A的成分是NaCl、NaClO4,故D正确。
选C。

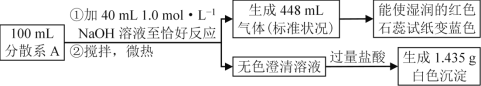
【题目】四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。
字母代号 | X | Y | Z | W |
结构或性质 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
(1)W在元素周期表中的位置为_________。
(2)四种元素的最高价氧化物对应的水化物中,有一种物质与其他三种物质在一定条件下均能发生化学反应,该元素是_____(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为____(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为______________。
(5)下列可用来判断Z和Mg的金属性强弱的方法是_____(填序号)。
a.测量两种元素单质的硬度和熔、沸点
b.比较单质与同浓度盐酸反应的剧烈程度
c.比较两种元素在化合物中化合价的高低
【题目】已知反应:4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),一定条件下测得反应过程中n(Cl2)与时间的关系如表所示:则4~6min内用O2的物质的量变化表示的反应速率是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(Cl2)/mol | 0 | 1.2 | 2.6 | 4.4 | 5.4 | 6.0 |
A.7.2molmin-1B.8.0molmin-1C.0.9molmin-1D.0.45molmin-1