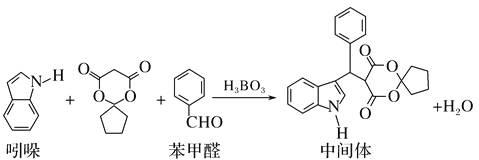
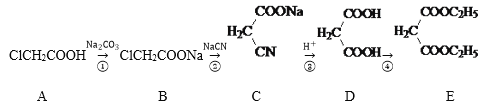
题目内容
【题目】SO2、Na2S2O3、Na2S、Na2SO3、Na2SO4等含硫化合物在工业上有广泛的用途。完成下列填空:
(1)硫原子最外层电子排布式_______________,钠原子的核外有______种能量不同的电子。Na2S的电子式____________。
(2)涉及元素形成简单离子半径大小顺序:__________________;请用原子结构知识说明氧与硫的非金属性强弱________________________________________________________。
(3)棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:
____S2O32-+____Cl2+____H2O→____SO42-+____Cl-+____H+,配平该反应方程式:若反应中生成2molSO42-,则转移电子_____mol。
(4)Na2S又称臭碱,用离子方程式说明Na2S溶液呈碱性的原因________。 SO2分子构型“V”形,则SO2是_____(选填“极性”、“非极性”)分子。列举一个实验事实说明SO2具有还原性_________。
(5)图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是____________(填微粒符号)。上述5种物质中,不能促进也不能抑制水电离的化合物____________。

【答案】3s23p4 4 ![]() S2->O2->Na+ O原子比S原子少一个电子层数,O原子半径较小,得电子能力较强,非金属较强 1 4 5 2 8 10 8 S2-+H2O
S2->O2->Na+ O原子比S原子少一个电子层数,O原子半径较小,得电子能力较强,非金属较强 1 4 5 2 8 10 8 S2-+H2O ![]() HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O![]() H2S+OH- 极性 SO2使酸性高锰酸钾溶液褪色 SO32- Na2SO4
H2S+OH- 极性 SO2使酸性高锰酸钾溶液褪色 SO32- Na2SO4
【解析】
(1)根据构造原理,先写出原子核外电子排布式,再确定原子的最外层电子排布式;处于同一能级的电子能量相同,处于不同能级的电子的能量不同;Na2S是离子化合物,Na+与S2-间通过离子键结合;
(2)涉及元素有O、Na、S,根据离子核外电子层数多的半径大于层数少的半径;当离子核外电子层相同时,核电荷数越大离子半径越小判断离子半径大小;元素的原子半径越小,吸引电子能力越强,元素的非金属性越强分析;
(3)反应中S2O32-中的硫由+2价升高到SO42-离子中的+6价,氯气中的氯元素由0价降低到-1价的Cl-,依据氧化还原反应得失电子守恒结合原子个数守恒规律配平方程式;依据S2O32-~2SO42-~8e-计算转移电子数目;
(4)Na2S是强碱弱酸盐,根据盐的水解规律分析Na2S溶液呈碱性的原因;SO2分子构型“V”形,分子中正负电荷重心若重合就是非极性分子,否则为极性分子;利用物质中S元素化合价的变化,结合氧化还原反应的规律判断SO2的还原性;
(5)依据亚硫酸钠为强电解质,完全电离,亚硫酸根离子为多元弱酸根离子,部分发生水解生成亚硫酸氢根离子和氢氧根离子,亚硫酸氢根离子继续水解生成硫离子和氢氧根离子结合水的电离进行排序;根据盐的水解规律判断对水的电离平衡无影响的物质。
(1)S是16号元素,原子核外电子排布式是1s22s22p63s23p4,所以硫原子最外层电子排布式是3s23p4;钠是11号元素,核外电子排布式是1s22s22p63s1,可见Na原子的核外有4种能量不同的电子。Na2S是离子化合物,Na+离子遇S2-之间通过离子键结合,则其电子式为![]() ;
;
(2)在上述物质中涉及的元素有O、Na、S三种,O2-、Na+、S2-核外电子排布分别是2、8;2、8;2、8、8;S2-核外有3个电子层,O2-、Na+只有2个电子层,所以S2-离子半径最大;O2-、Na+的核外电子排布相同,核电荷数越大离子半径越小,所以离子半径:O2->Na+,因此三种离子半径大小顺序是:S2->O2->Na+;
O、S是同一主族的元素,O是第二周期的元素,S是第三周期的元素,O原子比S原子少一个电子层数,O原子半径较小,得电子能力较强,因此元素的非金属性O比S强;
(3)由给出方程式可知:反应中硫元素的化合价由S2O32-中的+2价升高到SO42-离子中的+6价,升高4×2=8价;氯元素的化合价由Cl2中的由0价降低到-1价的氯离子,降低1×2×4=8价,所以依据氧化还原反应得失电子守恒,S2O32-系数为1,SO42-的系数是2,Cl2系数为4,Cl-的系数是8;依据原子个数守恒,反应方程式为:1S2O32-+4Cl2+5H2O→2SO42-+8Cl-+10H+;
若反应中生成0.2mol SO42-,依据S2O32-~2SO42-~8e-,可知转移电子数目为0.8mol;
(4) Na2S溶液显碱性,是因为硫离子水解,离子方程式:S2-+H2O ![]() HS-+OH-,反应产生的HS-进一步发生水解反应:HS-+H2O
HS-+OH-,反应产生的HS-进一步发生水解反应:HS-+H2O![]() H2S+OH-,当最终达到平衡时,溶液中c(OH-)>c(H+),因此溶液显碱性;
H2S+OH-,当最终达到平衡时,溶液中c(OH-)>c(H+),因此溶液显碱性;
SO2是V形分子,由于S=O共价键中O原子吸引电子的能力比S强,电子对偏小O原子一侧,因此导致分子中正负电荷重心不重合,故该物质为极性分子;S元素的最高化合价为+6价,SO2中S元素化合价为+4价,容易失去电子,被氧化为+6价,因此具有强的还原性,可以用酸性KMnO4溶液验证,将SO2通入到紫色KMnO4溶液中,若观察到SO2能够使酸性KMnO4溶液褪色,从而证明SO2具有还原性;
(5)亚硫酸钠虽然能水解,但程度不大,所以主要离子为钠离子和亚硫酸根离子,由于HSO3-还能少量水解,故氢氧根离子浓度略大于HSO3-,由于溶液呈碱性,所以H+是最小的,所以离子浓度大小关系为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),实验②是SO32-;
在SO2、Na2S2O3、Na2S、Na2SO3、Na2SO4五种物质中,SO2与水反应产生H2SO3,该物质电离产生H+,抑制水的电离;Na2S2O3、Na2S、Na2SO3都是强碱弱酸盐,弱酸根离子结合水电离产生的H+,促进了水的电离;而Na2SO4是强酸强碱盐,对水的电离平衡无影响,即Na2SO4不能促进也不能抑制水电离。

 名校课堂系列答案
名校课堂系列答案【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
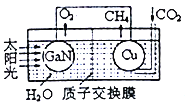
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。
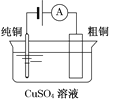
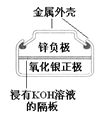
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
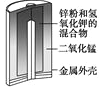
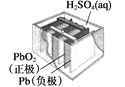
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
【题目】实验室用浓盐酸、二氧化锰共热制氯气,并用制得的氯气和氢氧化钙制取少量漂粉精。现已知反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O是放热反应。温度稍高会发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
现有3个同学分别设计的3套实验装置如图:

(1)C装置中发生反应的化学方程式为:___,E装置中发生反应的化学方程式为:___。
(2)请从以下几个方面对甲乙丙3套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表中空格中。___
a.不容易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.污染环境 f.可防止污染环境
优点 | 缺点 | |
甲装置 | ||
乙装置 | ||
丙装置 |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分的连接顺序是___(按气流流动的方向)。该组合中还缺少的装置是___(用文字说明),需要该装置的原因是___。
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过___mol。