题目内容
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为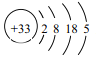 ,则其在周期表中的位置是______________________。
,则其在周期表中的位置是______________________。
(2)N元素非金属性比As强,下列说法正确的是___________________________。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
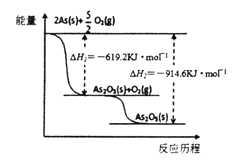
(3)根据下图写出As2O5分解为As2O3的热化学方程式______________________________________。
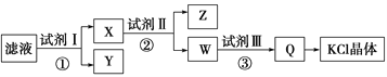
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应________(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________。
③写出过程Ⅲ的离子方程式_________________________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因________________________________。
【答案】(1)第四周期,VA族(2)②③
(3)As2O5(s)===As2O3(s)+O2(g)△H=+295.4kJ·mol-1
(4)①不是②浓缩结晶,过滤,洗涤,烘干③2AsO43-+2SO2+2H+===As2O3+2SO42-+H2O;酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率。
【解析】
试题(1)根据As的原子结构示意图可知,有4个电子层,在第四周期,最外层有5个电子,位于VA族。
(2)非金属性越强,气态氢化物热稳定性越强,最高价含氧酸的酸性越强,对同族元素来说,原子半径越小,答案选②③。
(3)根据图给数据,由As2O5分解为As2O3吸收热量为914.6-619.2=" +295.4" kJ·mol-1,所以反应的热化学方程式为As2O5(s) = As2O3(s) + O2(g) △H=" +295.4" kJ·mol-1。
(4)①As2S3、Na3AsS3中的S均为-2价,As为+3价,Na为+1价,生成物Na3AsO3中Na的化合价为+1价,As的化合价为+3价,S的化合价为-2价,所以所有元素的化合价没有发生变化,碱浸过程中发生的反应不是氧化还原反应。
②过程Ⅲ是由滤液得到固体的过程,所以系列操作包括浓缩结晶,过滤,洗涤,烘干。
③在过程Ⅲ中,Na3AsO4具有氧化性,SO2具有还原性,在酸性溶液中发生氧化还原反应,反应的离子方程式为2AsO4 3-+ 2SO2+ 2H+ ===As2O3 + 2SO42- + H2O。酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率,所以过程Ⅲ中,酸性越强,As2O3的产率越高。