题目内容
 硫及其化合物在国民生产中占有重要的地位.
硫及其化合物在国民生产中占有重要的地位.(1)为实现废旧印刷线路板综合利用,可用H2O2和稀H2SO4的混合液溶解处理产生的铜粉末,以制备硫酸铜.已知:
①Cu(s)+2H+(aq)+
| 1 | 2 |
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ?mol-1
Cu与H2O2和稀H2SO4的混合液反应生成Cu2+和H2O的热化学方程式为
Cu(s)+2H+(aq)+H2O2(l)=Cu2+(aq)+2H2O(l)△H=-319.68kJ?mol-1
Cu(s)+2H+(aq)+H2O2(l)=Cu2+(aq)+2H2O(l)△H=-319.68kJ?mol-1
,当有1mol H2O2参与反应时,转移电子的物质的量为2
2
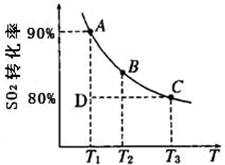
mol.(2)硫酸工业生产中涉及如下反应:2SO2(g)+O2(g)?2SO3(g),一定条件下,SO2的平衡转化率和温度的关系如图所示.该反应的△H
<
<
0(填“>”、“<”). 反应进行到状态D时,υ正>
>
υ逆(填“>”、“<”或“=”).(3)某温度时,将4mol SO2和2mol O2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol?L-1,则0~10min内的平均反应速率υ(SO2)=
80 L?mol-1
80 L?mol-1
,该温度下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=0.16mol?L-1?min-1
0.16mol?L-1?min-1
.如改变条件使上述反应的平衡常数K值增大,则该反应
ad
ad
(填写序号)a.反应一定正向移动 b.反应一定逆向移动
c.改变的条件可能是浓度或压强 d.移动时逆反应速率由小到大.
分析:(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的计算;
反应中H2O2起氧化剂作用,氧元素由-1价降低为-2价,据此计算转移电子物质的量;
(2)由图可知,温度越高SO2的转化率越小,即升高温度平衡向逆反应移动;
状态D时的SO2的转化率为80%,未达到90%,反应向正反应进行;
(3)测得SO3的浓度为1.6mol?L-1,由方程式可知△c(SO2)=△c(SO3),再根据v=
计算v(SO2);
利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算,平衡常数K值增大平衡正移,K只与温度有关.
反应中H2O2起氧化剂作用,氧元素由-1价降低为-2价,据此计算转移电子物质的量;
(2)由图可知,温度越高SO2的转化率越小,即升高温度平衡向逆反应移动;
状态D时的SO2的转化率为80%,未达到90%,反应向正反应进行;
(3)测得SO3的浓度为1.6mol?L-1,由方程式可知△c(SO2)=△c(SO3),再根据v=
| △c |
| △t |
利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算,平衡常数K值增大平衡正移,K只与温度有关.
解答:解:(1)已知:①、Cu(s)+2H+(aq)+
O2(g)=Cu2+(aq)+2H2O(l)△H=-221.45kJ/mol,
②、2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol,
由盖斯定律,①+②×
得:H2O2(l)+Cu(s)+2H+(aq)=Cu2+(aq)+2H2O(l),故△H=-221.45kJ/mol+(-196.46kJ/mol)×
=319.68kJ/mol,
则热化学方程式为:H2O2(l)+Cu(s)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol,
反应中H2O2起氧化剂作用,氧元素由-1价降低为-2价,故转移电子物质的量为1mol×[(-1)-(-2)]=2mol,
故答案为:H2O2(l)+Cu(s)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol;2;
(2)由图可知,温度越高SO2的转化率越小,即升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0;
状态D时的SO2的转化率为80%,未达到90%,反应向正反应进行,则v正>v逆,故答案为:<;>;
(3)测得SO3的浓度为1.6mol?L-1,由方程式可知△c(SO2)=△c(SO3)=1.6mol?L-1,故v(SO2)=
=0.16mol?L-1?min-1;
利用三段式计算平衡时各组分的浓度,则:
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):2 1 0
变化(mol/L):1.6 0.8 1.6
平衡(mol/L):0.4 0.2 1.6
故平衡常数k=
=80,
改变条件使上述反应的平衡常数K值增大,则平衡正移,所以移动时逆反应速率由小到大,K只与温度有关,改变浓度或压强K不变,
a.反应一定正向移动,故a正确,
b.反应一定逆向移动,故b错误,
c.改变的条件可能是浓度或压强,K只与温度有关,改变浓度或压强K不变,故c错误,
d.移动时逆反应速率由小到大,平衡正移,所以移动时逆反应速率由小到大,故d正确;
故答案为:0.16mol?L-1?min-1;80;ad.
| 1 |
| 2 |
②、2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol,
由盖斯定律,①+②×
| 1 |
| 2 |
| 1 |
| 2 |
则热化学方程式为:H2O2(l)+Cu(s)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol,
反应中H2O2起氧化剂作用,氧元素由-1价降低为-2价,故转移电子物质的量为1mol×[(-1)-(-2)]=2mol,
故答案为:H2O2(l)+Cu(s)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol;2;
(2)由图可知,温度越高SO2的转化率越小,即升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0;
状态D时的SO2的转化率为80%,未达到90%,反应向正反应进行,则v正>v逆,故答案为:<;>;
(3)测得SO3的浓度为1.6mol?L-1,由方程式可知△c(SO2)=△c(SO3)=1.6mol?L-1,故v(SO2)=
| 1.6mol/L |
| 10min |
利用三段式计算平衡时各组分的浓度,则:
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):2 1 0
变化(mol/L):1.6 0.8 1.6
平衡(mol/L):0.4 0.2 1.6
故平衡常数k=
| (1.6)2 |
| (0.4)2×0.2 |
改变条件使上述反应的平衡常数K值增大,则平衡正移,所以移动时逆反应速率由小到大,K只与温度有关,改变浓度或压强K不变,
a.反应一定正向移动,故a正确,
b.反应一定逆向移动,故b错误,
c.改变的条件可能是浓度或压强,K只与温度有关,改变浓度或压强K不变,故c错误,
d.移动时逆反应速率由小到大,平衡正移,所以移动时逆反应速率由小到大,故d正确;
故答案为:0.16mol?L-1?min-1;80;ad.
点评:本题考查热化学方程式的书写、化学平衡图象与影响因素、化学反应速率及化学平衡常数的计算等,难度中等,注意基础知识的全面掌握,注意(2)图象中曲线上的各点都是平衡点.

练习册系列答案
相关题目
 (2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
(2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题: