题目内容
硫及其化合物在化学工业中应用非常广泛.
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化.
如:CO(g)+NO2(g)?NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
则用标准状况下的3.36L CO还原NO2至N2(CO完全反应)的整个过程中放出的热量为
kJ(用含有a和b的代数式表示).
(2)工业上生产硫酸时,将SO2氧化为SO3是关键一步.
①某温度下,已知2SO2(g)+O2(g)?2SO3(g),△H=-196kJ?mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K=
②一定条件下,向一带活塞的密闭容器中充入2mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g)?2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是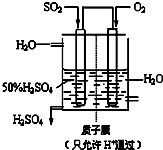
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器内压强不变,充入1mol SO3
D.升高温度
E.移动活塞压缩气体
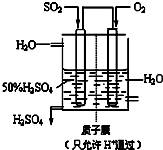
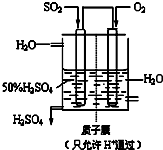
(3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中
NO2
NO2
能导致光化学烟雾的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化.
如:CO(g)+NO2(g)?NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
则用标准状况下的3.36L CO还原NO2至N2(CO完全反应)的整个过程中放出的热量为
| 3(2a+b) |
| 80 |
| 3(2a+b) |
| 80 |
(2)工业上生产硫酸时,将SO2氧化为SO3是关键一步.
①某温度下,已知2SO2(g)+O2(g)?2SO3(g),△H=-196kJ?mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K=
2.5mol-1?L
2.5mol-1?L
,用O2表示的反应速率为0.02mol?L-1?min-1
0.02mol?L-1?min-1
.②一定条件下,向一带活塞的密闭容器中充入2mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g)?2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是
AE
AE
(填字母).
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器内压强不变,充入1mol SO3
D.升高温度
E.移动活塞压缩气体
(3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式
SO2+2H2O=SO42-+4H++2e-
SO2+2H2O=SO42-+4H++2e-
.分析:(1)从光化学烟雾的形成原因进行分析,主要是汽车尾气中排放的氮氧化物在大气中发生复杂的变化形成的;催化净化汽车尾气是当前主要的措施,使有毒气体转化为无毒气体,标准状况下的3.36L CO还原NO2至N2(CO完全反应)的整个过程中放出的热量,依据题给热化学方程式结合盖斯定律进行合并消去一氧化碳,计算得到;
(2)①依据热化学方程式结合平衡三段式计算,求的用O2表示的反应速率,利用得到各物质的平衡浓度计算化学平衡常数;
②依据恒温恒容和恒温恒压条件下的反应特点,结合影响化学平衡的因素进行分析推断;
(3)原电池负极发生氧化反应,SO2被氧化生成SO42-;
(2)①依据热化学方程式结合平衡三段式计算,求的用O2表示的反应速率,利用得到各物质的平衡浓度计算化学平衡常数;
②依据恒温恒容和恒温恒压条件下的反应特点,结合影响化学平衡的因素进行分析推断;
(3)原电池负极发生氧化反应,SO2被氧化生成SO42-;
解答:解:(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中氮氧化物是引起光化学烟雾的原因,故NO2能导致光化学烟雾的形成;
①CO(g)+NO2(g)?NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
②2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
①×2+②得到:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-(2a+b)kJ?mol-1
标准状况下的3.36L CO的物质的量═
=0.15mol;根据合并得到的热化学方程式可以计算得到标准状况0.15molCO还原NO2至N2(CO完全反应)的整个过程中放出的热量为:
=
(2a+b)KJ;
故答案为:NO2;
;
(2)①2SO2(g)+O2(g)?2SO3(g),△H=-196kJ?mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,消耗SO2的物质的量为2mol,根据化学平衡列式计算:
2SO2 +O2?2SO3,
起始量(mol) 4.0 5.0 0
变化量(mol) 2.0 1.0 2.0
平衡量(mol) 2.0 4.0 2.0
K=
=
=2.5 mol-1?L;
v(O2)=
=0.02 mol?L-1?min-1
②A.保持温度和容器体积不变,充入2mol SO3,平衡向逆反应分析移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故A正确;
B.保持温度和容器体积不变,充入2mol N2,对平衡移动没有影响,各物质的浓度不变,故B错误;
C.保持温度和容器内压强不变,充入1mol SO3,处于等效平衡状态,浓度不变,故D错误;
D.升高温度,平衡向逆反应分析移动,SO3的浓度减小,故E错误;
E.移动活塞压缩气体,体积减小,各物质的浓度都增大,故F正确.
故答案为:①2.5 mol-1?L; 0.02 mol?L-1?min-1; ②AE;
(3)原电池负极发生氧化反应,SO2被氧化生成SO42-,负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
①CO(g)+NO2(g)?NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
②2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
①×2+②得到:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-(2a+b)kJ?mol-1
标准状况下的3.36L CO的物质的量═
| 3.36L |
| 22.4L/mol |
| 0.15mol×(2a+b) |
| 4 |
| 3 |
| 80 |
故答案为:NO2;
| 3(2a+b) |
| 80 |
(2)①2SO2(g)+O2(g)?2SO3(g),△H=-196kJ?mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,消耗SO2的物质的量为2mol,根据化学平衡列式计算:
2SO2 +O2?2SO3,
起始量(mol) 4.0 5.0 0
变化量(mol) 2.0 1.0 2.0
平衡量(mol) 2.0 4.0 2.0
K=
| [SO3]2 |
| [SO2]2?[O2] |
(
| ||||
(
|
v(O2)=
| ||
| 5min |
②A.保持温度和容器体积不变,充入2mol SO3,平衡向逆反应分析移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故A正确;
B.保持温度和容器体积不变,充入2mol N2,对平衡移动没有影响,各物质的浓度不变,故B错误;
C.保持温度和容器内压强不变,充入1mol SO3,处于等效平衡状态,浓度不变,故D错误;
D.升高温度,平衡向逆反应分析移动,SO3的浓度减小,故E错误;
E.移动活塞压缩气体,体积减小,各物质的浓度都增大,故F正确.
故答案为:①2.5 mol-1?L; 0.02 mol?L-1?min-1; ②AE;
(3)原电池负极发生氧化反应,SO2被氧化生成SO42-,负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
点评:本题考查了汽车尾气的处理和带来的危害,结合热化学方程式,根据盖斯定律进行有关计算,化学平衡常数和速率的基本计算,影响平衡的因素的分析判断,原电池原理的应用.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题: