题目内容
硫及其化合物在生产、生活中有广泛的应用,请回答下列问题:
(1)已知S的燃烧热为297kJ?mol-1,H2S完全燃烧的热化学方程式为H2S(g)+1.5O2(g)=SO2(g)+H2O (l)△H=-586.kJ/mol,H2S不完全燃烧生成固态硫和液态水.写出H2S不完全燃烧的热化学方程式 ;
(2)SO2溶于水生成弱酸H2SO3,写出H2SO3的电离方程式 ;
(3)Na2SO3溶液通常现用现配,写出Na2SO3溶液所含离子浓度的大小关系(由大到小) ;
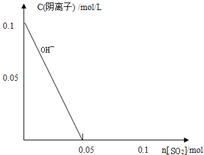
(4)向1L0.1mol/L的NaOH溶液中不断通入标准状况下的SO2气体2.24L(假设溶液体积一直保持不变),请在图中画出SO2通入过程中溶液中各阴离子浓度与SO2物质的量的关系变化图象(如图中OH-所示).
(1)已知S的燃烧热为297kJ?mol-1,H2S完全燃烧的热化学方程式为H2S(g)+1.5O2(g)=SO2(g)+H2O (l)△H=-586.kJ/mol,H2S不完全燃烧生成固态硫和液态水.写出H2S不完全燃烧的热化学方程式
(2)SO2溶于水生成弱酸H2SO3,写出H2SO3的电离方程式
(3)Na2SO3溶液通常现用现配,写出Na2SO3溶液所含离子浓度的大小关系(由大到小)
(4)向1L0.1mol/L的NaOH溶液中不断通入标准状况下的SO2气体2.24L(假设溶液体积一直保持不变),请在图中画出SO2通入过程中溶液中各阴离子浓度与SO2物质的量的关系变化图象(如图中OH-所示).

分析:(1)依据燃烧热概念、热化学方程式和盖斯定律计算得到;
(2)亚硫酸是多元弱酸分步电离;
(3)亚硫酸钠是强碱弱酸盐在水溶液中水解呈碱性,据此分析比较离子浓度;
(4)二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水,继续通入二氧化硫会和亚硫酸钠溶液反应生成亚硫酸氢钠,依据反应过程中阴离子的变化和定量关系绘制离子变化的图象.
(2)亚硫酸是多元弱酸分步电离;
(3)亚硫酸钠是强碱弱酸盐在水溶液中水解呈碱性,据此分析比较离子浓度;
(4)二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水,继续通入二氧化硫会和亚硫酸钠溶液反应生成亚硫酸氢钠,依据反应过程中阴离子的变化和定量关系绘制离子变化的图象.
解答:解:(1)已知S的燃烧热为297kJ?mol-1,热化学方程式为①S(s)+O2(g)=SO2(g)△H=-297KJ/mol,
H2S完全燃烧的热化学方程式为②H2S(g)+
O2(g)=SO2(g)+H2O (l)△H=-586.kJ/mol,
依据盖斯定律②-①得到H2S不完全燃烧生成固态硫和液态水:H2S(g)+
O2(g)=S(s)+H2O (l)△H=-289.16kJ/mol,
故答案为:H2S(g)+0.5O2(g)=S(s)+H2O (l)△H=-289.16kJ/mol;
(2)亚硫酸是多元弱酸分步电离,电离离子方程式为:H2SO3?H++HSO3-、HSO3-?H++SO32-,
故答案为:H2SO3?H++HSO3-、HSO3-?H++SO32-;
(3)Na2SO3溶液中亚硫酸根离子是弱酸阴离子,水溶液中水解显碱性,所含离子浓度的大小关系:[Na+]>[SO32-]>[OH-]>[HSO3-]>[H+],
故答案为:[Na+]>[SO32-]>[OH-]>[HSO3-]>[H+];
(4)向1L0.1mol/L的NaOH溶液中含有氢氧化钠物质的量为0.1mol,不断通入标准状况下的SO2气体2.24L(假设溶液体积一直保持不变)物质的量为0.1mol,二氧化硫通入氢氧化钠溶液中反应的过程,SO2+2NaOH=Na2CO3+H2O SO2+H2O+Na2SO3=2NaHSO3,随反应进行氢氧根离子浓度减小,亚硫酸根离子增大到最大为0.05mol,继续通入
二氧化硫气体0.05mol,会和0.05mol亚硫酸根离子反应生成0.1mol亚硫酸氢根离子,则阴离子浓度与SO2物质的量的关系变化图象为: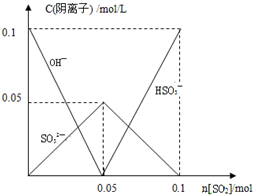 ,故答案为:
,故答案为: .
.
H2S完全燃烧的热化学方程式为②H2S(g)+
| 3 |
| 2 |
依据盖斯定律②-①得到H2S不完全燃烧生成固态硫和液态水:H2S(g)+
| 1 |
| 2 |
故答案为:H2S(g)+0.5O2(g)=S(s)+H2O (l)△H=-289.16kJ/mol;
(2)亚硫酸是多元弱酸分步电离,电离离子方程式为:H2SO3?H++HSO3-、HSO3-?H++SO32-,
故答案为:H2SO3?H++HSO3-、HSO3-?H++SO32-;
(3)Na2SO3溶液中亚硫酸根离子是弱酸阴离子,水溶液中水解显碱性,所含离子浓度的大小关系:[Na+]>[SO32-]>[OH-]>[HSO3-]>[H+],
故答案为:[Na+]>[SO32-]>[OH-]>[HSO3-]>[H+];
(4)向1L0.1mol/L的NaOH溶液中含有氢氧化钠物质的量为0.1mol,不断通入标准状况下的SO2气体2.24L(假设溶液体积一直保持不变)物质的量为0.1mol,二氧化硫通入氢氧化钠溶液中反应的过程,SO2+2NaOH=Na2CO3+H2O SO2+H2O+Na2SO3=2NaHSO3,随反应进行氢氧根离子浓度减小,亚硫酸根离子增大到最大为0.05mol,继续通入
二氧化硫气体0.05mol,会和0.05mol亚硫酸根离子反应生成0.1mol亚硫酸氢根离子,则阴离子浓度与SO2物质的量的关系变化图象为:
 ,故答案为:
,故答案为: .
.点评:本题考查了热化学方程式和盖斯定律计算应用,弱电解质定律和盐类水解的离子比较应用,图象计算分析,题目难度中等.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
 (2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
(2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.