题目内容
高温下,某反应达平衡,化学平衡常数表达式为: ,恒容时,温度升高H2浓度减小。下列说法正确的是
,恒容时,温度升高H2浓度减小。下列说法正确的是
A.该反应化学方程式为:CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) |
| B.恒温恒容下,反应达平衡时,再通入一定量的CO2,CO的体积分数一定增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |
D
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在一定温度下,容积为2L的密闭容器中x(g).与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若其他条件不变,温度为T1和T2时,Y的体积分数与时间的关系如图(2)所示。下列说法正确的是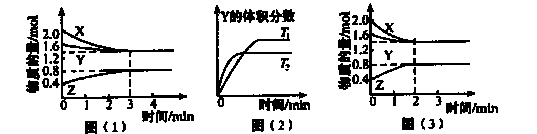
A.容器内发生的反应可以表示为2X(g)+Y(g)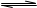 2Z(g) 2Z(g) |
| B.保持其他条件不变,升高温度,该反应的平衡常数K减小 |
| C.反应前3 min内,v(Z)≈0.067 mol·L-1·min-1 |
| D.若改变反应条件,反应进程如图(3)所示,则改变的条件是增大压强 |
下列有关说法正确的是
| A.反应SiO2(s)+ 3C(s) =" SiC(s)" + 2CO(g)室温下不能自发进行,则该反应的△H<0 |
| B.铅蓄电池放电过程中,正极质量增加,负极质量减小 |
C.25℃下,在NH3·H2O稀溶液中,加水, 的值不变 的值不变 |
| D.在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )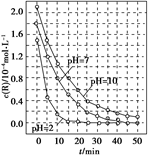
| A.在0-50 min之间, pH = 2和PH = 7时R的降解百分率不相等 |
| B.在 20-25 min之间, pH =" 10" 时R的平均降解速率为0.04 mol?L-1?min-1 |
| C.溶液酸性越强, R 的降解速率越小 |
| D.R的起始浓度和溶液的PH均影响R的降解速率 |
在相同条件下(T=500K),相同体积的甲乙两容器,甲中充入1gSO2和1gO2,乙中充入2gSO2和2gO2,下列叙述中不正确的是( )
| A.反应速率:乙>甲 | B.平衡混合物中SO2的体积分数:乙>甲 |
| C.SO2的转化率:乙>甲 | D.平衡时O2的浓度:乙>甲 |
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)
 Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
NO2和N2O4可相互转化:2NO2(g)  N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是
N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是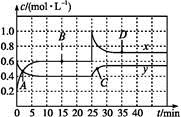
| A.图中共有两条曲线x和y,其中曲线y表示NO2浓度随时间的变化 |
| B.A、B、C、D四个点中,表示化学反应处于平衡状态的点是B和C |
| C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |
| D.若要达到与D相同的状态,在25 min时还可采取的措施是适当缩小容器体积 |
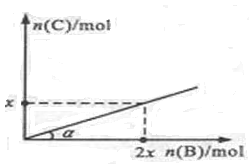
 3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )
3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )  2C(g)+ D(g);ΔH<0,在一定温度和压强下达到平衡。若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。 则下列说法中正确的是
2C(g)+ D(g);ΔH<0,在一定温度和压强下达到平衡。若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。 则下列说法中正确的是