题目内容
11.下列各组中的离子,能在溶液中大量共存的是( )| A. | Na+Mg2+ Cl- OH- | B. | H+Ca2+ CO32-NO3- | ||
| C. | Cu2+K+SO42-NO3- | D. | Na+ HCO3-OH- Ca2+ |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,以此来解答.
解答 解:A.Mg2+、OH-结合生成沉淀,不能大量共存,故A错误;
B.Ca2+、CO32-结合生成沉淀,H+、CO32-结合生成水和气体,不能大量共存,故B错误;
C.该组离子之间不反应,可大量共存,故C正确;
D.结HCO3-、OH-、Ca2+合生成沉淀和水,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.在光照条件下,将等物质的量的甲烷和氯气充分反应,所得产物中物质的量最多的是( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CHCl3 | D. | HCl |
19.下列各溶液中,有关离子的物质的量浓度关系正确的是( )
| A. | 已知H2C2O4为二元弱酸,则Na2C2O4溶液:c (OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) | |
| B. | 饱和碳酸钠溶液中:c(Na+)=2c(CO32-) | |
| C. | 饱和食盐水中:c(Na+)+c (OH-)=c(Cl-)+c(H+) | |
| D. | 50℃时,pH=12的NaOH溶液中:c(OH-)=1.0×10-2 mol•L-1 |
6.加入KOH溶液后,下列溶液中哪种离子数目会减少( )
| A. | CO32- | B. | Mg2+ | C. | SO42- | D. | Na+ |
16.某合作学习小组讨论辨析:( )
①生活中使用的漂白粉和肥皂都是混合物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤水玻璃、有色玻璃和果冻都是胶体
⑥汽油属于混合物,而液氯、冰醋酸均属于纯净物.
①生活中使用的漂白粉和肥皂都是混合物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤水玻璃、有色玻璃和果冻都是胶体
⑥汽油属于混合物,而液氯、冰醋酸均属于纯净物.
| A. | ①②③⑤ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②④⑥ |
3.A、B、C、D、E、F是周期表中短周期的六种元素,有关性质或结构信息如表:
回答下列问题:
(1)写出C、F的元素符号Na、N;B在周期表中的位置为第三周期ⅢA族.
(2)C与D形成D的最低价化合物的电子式为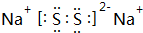 .
.
(3)写出由上述元素形成的可用于漂白的物质的化学式(至少4种)O3、Cl2、Na2O2、NaClO、SO2等.
(4)能证明A与D非金属性强弱的实验事实是(用化学方程式表示)2H2S+O2=2S↓+2H2O.
| 元素 | 有关性质或结构信息 |
| A | 地壳中含量最多的元素 |
| B | B阳离子与A离子电子数相同,且是所在周期中单核离子半径最小的 |
| C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D | D单质是制造黑火药的一种成分,也可用于杀菌消毒 |
| E | E与D同周期,且在该周期中原子半径最小 |
| F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
(1)写出C、F的元素符号Na、N;B在周期表中的位置为第三周期ⅢA族.
(2)C与D形成D的最低价化合物的电子式为
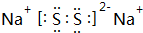 .
.(3)写出由上述元素形成的可用于漂白的物质的化学式(至少4种)O3、Cl2、Na2O2、NaClO、SO2等.
(4)能证明A与D非金属性强弱的实验事实是(用化学方程式表示)2H2S+O2=2S↓+2H2O.
1.下列离子方程式正确且能解释事实的是( )
| A. | SO2使紫色石蕊溶液变红色:SO2+H2O═2H++SO32- | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2═2I2+2H2O | |
| D. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |

