题目内容
16.某合作学习小组讨论辨析:( )①生活中使用的漂白粉和肥皂都是混合物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤水玻璃、有色玻璃和果冻都是胶体
⑥汽油属于混合物,而液氯、冰醋酸均属于纯净物.
| A. | ①②③⑤ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②④⑥ |
分析 ①纯净物是同种物质组成,混合物是不同物质组成;
②离子化合物包括两大类:一是由金属和非金属元素共同构成的化合物绝大多数是离子化合物;二是所有的铵盐;
③常见的电解质:酸、碱、盐、金属氧化物、水;非电解质:蔗糖、酒精、非金属氧化物和氨气;强电解质:强酸、强碱、绝大多数的盐、金属氧化物;
④根据酸碱盐和氧化物的概念来判断;
⑤根据胶体是分散质为直径1-100nm的分散系;
⑥纯净物是同种物质组成,混合物是不同物质组成.
解答 解:①漂白粉是氯化钙和次氯酸钙的混合物,肥皂是脂肪酸盐和泡花碱的混合物,故①正确;
②离子化合物包括两大类:一是由金属和非金属元素共同构成的化合物绝大多数是离子化合物;二是所有的铵盐;故碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物,故②正确;
③根据常见的电解质:酸、碱、盐、金属氧化物、水;非电解质:蔗糖、酒精、非金属氧化物和氨气;强电解质:强酸、强碱、绝大多数的盐、金属氧化物;可知,硫酸钡为强电解质,故③错误;
④酸:电离出的阳离子全部为氢离子的化合物;碱:电离出的阴离子全部为氢氧根的化合物;盐:电离出的阳离子为金属离子或铵根离子,阴离子为酸根离子的化合物;氧化物:由两种元素构成,其中一种为氧元素的化合物,故④正确;
⑤水玻璃是硅酸钠的水溶液,不属于胶体,有色玻璃和果冻都是胶体,故⑤错误;
⑥汽油是多种烷烃的混合物,而液氯即液态的氯气,冰醋酸即乙酸,均属于纯净物,故⑥正确;
故选D.
点评 本题主要考查了物质的组成与分类,难度不大,掌握物质的组成是解题的关键.

练习册系列答案
相关题目
6.立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得.用含锌废料制取立德粉的实验流程如图:
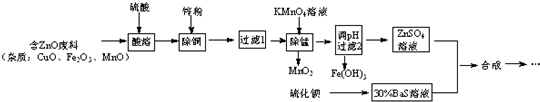
(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有托盘天平.
(2)加入锌粉被还原的离子有Fe3+、Cu2+.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解.
(5)两种溶液合成立德粉,还需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是Cu2+、Mn2+及Fe3+没有除尽.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
实验中可选用的试剂:30% H2O2、3.0mol•L-1 H2SO4、1.0mol•L-1 NaOH.
实验步骤依次为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮;
②加入适量30% H2O2,使其充分反应;
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
④过滤得滤液.

(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有托盘天平.
(2)加入锌粉被还原的离子有Fe3+、Cu2+.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解.
(5)两种溶液合成立德粉,还需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是Cu2+、Mn2+及Fe3+没有除尽.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验步骤依次为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮;
②加入适量30% H2O2,使其充分反应;
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
④过滤得滤液.
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol H2O中含有的原子数为NA | |
| B. | 2g H2中含有的氢原子数为2NA | |
| C. | 常温常压下,11.2L N2中含有的分子数为0.5N A | |
| D. | 1L 0.1 mol/L NaNO3溶液中含有的钠离子数为NA |
4.NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA | |
| B. | 由2H和18O所组成的水11 g,其中所含的中子数为4NA | |
| C. | 常温下丁烯和环丙烷组成的42 g混合气体中H原子数为6NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA |
11.下列各组中的离子,能在溶液中大量共存的是( )
| A. | Na+Mg2+ Cl- OH- | B. | H+Ca2+ CO32-NO3- | ||
| C. | Cu2+K+SO42-NO3- | D. | Na+ HCO3-OH- Ca2+ |
1.下列反应过程符合如图所示关系的是( )
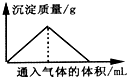

| A. | 向漂白粉溶液中通入CO2气体至过量 | |
| B. | 向Na2SiO3溶液中通入HCl气体至过量 | |
| C. | 向Ba(OH)2和KOH混合溶液中通入CO2气体至过量 | |
| D. | 向Na[Al(OH)4]溶液中通入HCl气体至过量 |
8.化学在生产和生活中有着广泛的应用.下列说法错误的是( )
| A. | 二氧化硫在食品加工中可用作食品增白剂 | |
| B. | 航天飞机上的隔热陶瓷瓦属于复合材料 | |
| C. | 用活性炭做净化剂除去冰箱中异味 | |
| D. | 含H2SO4的废水用BaCl2处理后不可直接排放 |
5.如图实验能达到实验目的且符合安全要求的是( )
| A. | 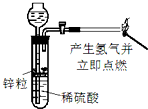 制备并检验氢气的可燃性 | B. | 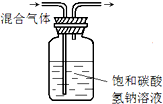 除去CO2中的HCl | ||
| C. | 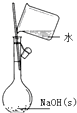 配置一定物质的量浓度的NaOH溶液 | D. |  制备氢氧化亚铁并观察其颜色 |
6.某溶液中含K+、Al3+、NH4+、SO42-.取500mL该溶液加入过量的氢氧化钡溶液,经过滤、洗涤、干燥,称重得到9.32g固体1,并收集到224mL(标准状况)气体.在滤液中通入过量的CO2,经过滤、洗涤、灼烧,称重得到0.51g固体2.原溶液中K+的浓度为( )
| A. | 0.08mol/L | B. | 0.04mol/L | C. | 0.02mol/L | D. | 0.01mol/L |