题目内容
20.某课外小组探索利用废合金(含有铝、铁、铜)粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如图:
试回答下列问题:
(1)所加试剂①、②分别是氢氧化钠溶液、稀硫酸.
(2)操作①的名称为过滤,所用的仪器除铁架台、铁圈和烧杯,还需要的用品有漏斗、玻璃棒、滤纸.
(3)写出A→D反应离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)滤液E经蒸发浓缩、冷却结晶得绿矾晶体,然后再经过滤、洗涤、干燥即得成品.洗涤时,下列试剂最好选用c.
a.稀H2SO4 b.蒸馏水 c.酒精 d.NaOH溶液
(5)由滤渣F制CuSO4溶液有途径I和途径Ⅱ两种,你认为最佳途径是途径Ⅱ,理由是途径Ⅰ消耗硫酸量多,且产生二氧化硫污染环境.
分析 根据题中各物质转化关系,滤渣B经过系列变化最终得到绿矾和胆矾,所以滤渣B中含有铜和铁,D与盐酸反应生成氯化铝,则D为氢氧化铝,所以滤液A中含有铝元素,所以实验流程为:废合金(含有铝、铁、铜)粉末中加入足量烧碱溶液,只有铝与其反应而溶解,过滤后得滤渣B的成分为铁和铜,滤液A为偏铝酸钠溶液;滤液A中通入过量的二氧化碳气体,得氢氧化铝沉淀,滤渣B中加入稀硫酸,过滤得滤液E为硫酸化亚铁溶液,将硫酸亚铁溶液经蒸发浓缩、冷却结晶得绿矾晶体,然后再经过滤、用酒精洗涤、干燥即得成品,用酒精洗涤可以减少硫酸亚铁的溶解而损失,同时容易干燥,滤渣F为铜,途径Ⅰ为铜与足量的浓硫酸生成硫酸铜,同时会生成二氧化硫气体,途径Ⅱ为铜与氧气反应生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜,所以途径Ⅱ中硫酸利用率高且没有污染,据此答题.
解答 解:根据题中各物质转化关系,滤渣B经过系列变化最终得到绿矾和胆矾,所以滤渣B中含有铜和铁,D与盐酸反应生成氯化铝,则D为氢氧化铝,所以滤液A中含有铝元素,所以实验流程为:废合金(含有铝、铁、铜)粉末中加入足量烧碱溶液,只有铝与其反应而溶解,过滤后得滤渣B的成分为铁和铜,滤液A为偏铝酸钠溶液;滤液A中通入过量的二氧化碳气体,得氢氧化铝沉淀,滤渣B中加入稀硫酸,过滤得滤液E为硫酸化亚铁溶液,将硫酸亚铁溶液经蒸发浓缩、冷却结晶得绿矾晶体,然后再经过滤、用酒精洗涤、干燥即得成品,用酒精洗涤可以减少硫酸亚铁的溶解而损失,同时容易干燥,滤渣F为铜,途径Ⅰ为铜与足量的浓硫酸生成硫酸铜,同时会生成二氧化硫气体,途径Ⅱ为铜与氧气反应生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜,所以途径Ⅱ中硫酸利用率高且没有污染,
(1)根据上面的分析可知,试剂①为氢氧化钠溶液,试剂②为稀硫酸,
故答案为:氢氧化钠溶液;稀硫酸;
(2)操作①的名称为过滤,所用的仪器除铁架台、铁圈和烧杯,还需要的用品有漏斗、玻璃棒、滤纸,
故答案为:过滤;漏斗、玻璃棒、滤纸;
(3)A→D为偏铝酸钠溶液与过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)硫酸亚铁溶液经蒸发浓缩、冷却结晶得绿矾晶体,然后再经过滤、洗涤、干燥即得成品,用酒精洗涤可以减少硫酸亚铁的溶解而损失,同时容易干燥,所以洗涤时用酒精洗涤,故选c,
故答案为:冷却结晶;c;
(5)由上面分析可知,由滤渣F制CuSO4溶液最好用途径Ⅱ,因为途径Ⅰ消耗硫酸量多,且产生二氧化硫污染环境,
故答案为:途径Ⅱ;途径Ⅰ消耗硫酸量多,且产生二氧化硫污染环境.
点评 本题主要考查了从工业废料中制取纯净物,注意从框图转化中找出有用信息,利用有关的化学反应进行解答,难度中等.

 名校课堂系列答案
名校课堂系列答案①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3.
| A. | 质量:④<①<③<② | B. | 密度:①<④<③<② | ||
| C. | 体积:④<①<②<③ | D. | 氢原子数:②<④<③<① |
| A. | Na+Mg2+ Cl- OH- | B. | H+Ca2+ CO32-NO3- | ||
| C. | Cu2+K+SO42-NO3- | D. | Na+ HCO3-OH- Ca2+ |
| A. | 二氧化硫在食品加工中可用作食品增白剂 | |
| B. | 航天飞机上的隔热陶瓷瓦属于复合材料 | |
| C. | 用活性炭做净化剂除去冰箱中异味 | |
| D. | 含H2SO4的废水用BaCl2处理后不可直接排放 |
| A. | 铁、铝在常温下都能被浓硫酸“钝化” | |
| B. | 足量铝分别与含1molHCl、l mol NaOH的溶液反应,产生相同量的氢气 | |
| C. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| D. | 浓硫酸与铜反应既体现了其强氧化性又体现了其酸性 |
| A. | 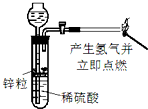 制备并检验氢气的可燃性 | B. | 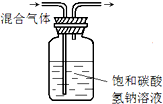 除去CO2中的HCl | ||
| C. | 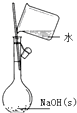 配置一定物质的量浓度的NaOH溶液 | D. |  制备氢氧化亚铁并观察其颜色 |
| A. | 氨气与氯化氢合成氯化铵 | B. | 氢气与氯气合成氯化氢 | ||
| C. | 蔗糖溶于水 | D. | 加热KMnO4分解制O2 |
| A. | 氦气>氧气>氮气 | B. | 氧气>氮气>氦气 | C. | 氧气>氦气>氮气 | D. | 氦气>氮气>氧气 |
| A. | 硫酸、纯碱、明矾、二氧化硫 | B. | 硝酸、烧碱、碳酸钙、氯化钠 | ||
| C. | 醋酸、苛性钠、碳酸钠、氨水 | D. | 盐酸、熟石灰、苛性钠、乙醇 |