题目内容
结合下图判断,下列叙述正确的是
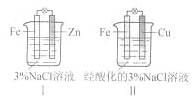

| A.Ⅰ是验证牺牲阳极的阴极保护法的实验装置 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
A
装置I为中性溶液下的锌的吸氧腐蚀
正极:O2+2H2O+4e-=4OH-,负极:Zn-2e-=Zn2+
装置II为酸性情况下的铁铜原电池;
正极:2H++2e-=H2↑,负极:Fe-2e-=Fe2+
故:装置I是把铁做原电池的正极(阳极),得到保护,表述正确;而两装置中只有装置II中才会生成亚铁离子,故D选项错误。
正极:O2+2H2O+4e-=4OH-,负极:Zn-2e-=Zn2+
装置II为酸性情况下的铁铜原电池;
正极:2H++2e-=H2↑,负极:Fe-2e-=Fe2+
故:装置I是把铁做原电池的正极(阳极),得到保护,表述正确;而两装置中只有装置II中才会生成亚铁离子,故D选项错误。

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
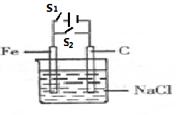
 。下列相关描述错误的是
。下列相关描述错误的是
 溶液、Fe
溶液、Fe )
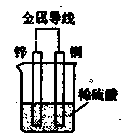
) 溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。
溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。