题目内容
(5分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl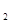 溶液、Fe
溶液、Fe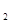 (SO
(SO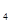 )
) 溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。
溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。
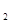 溶液、Fe
溶液、Fe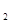 (SO
(SO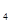 )
) 溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。
溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。
略

练习册系列答案
相关题目

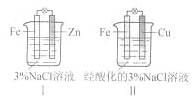
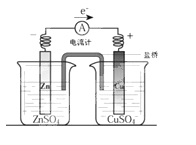
 2Ag+Zn(OH)2,在此电池放电时,负极上发生反应的物质是( )
2Ag+Zn(OH)2,在此电池放电时,负极上发生反应的物质是( )
 (aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0
(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0 2CO2(g)+3H2
2CO2(g)+3H2 O(l) ;△H<0
O(l) ;△H<0