��Ŀ����
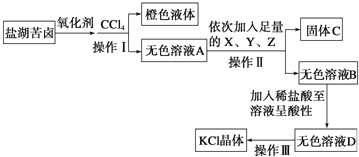
����Ŀ��ij�о���ѧϰС����ȡ�κ���±��Ũ��Һ������Ca2+��Mg2+��Br-��SO42-��Cl-�ȣ�����ȡ�ϴ������Ȼ��ؾ��弰Һ�壬����������������̣�
�ش��������⣺
��1�������������ƣ�_____��Ҫ�ӳ�ɫҺ���з�����壬����ȡ�IJ�����Ҫ����Ҫ�����������ƾ��ơ��¶ȼơ������ܡ�ţ�ǹܣ������ܣ�����ƿ�⣬����Ҫ_____��
��2����֪�Լ�X��BaCl2��Һ��Y��KOH��Һ�����Լ�Z�Ļ�ѧʽΪ_____������SO42-�ѳ����ķ�����_____��
��3���������ľ���������裺����ҺD����_____�в��������ż��ϼ��ȣ�ͬʱ�ò��������Ͻ��裬ֱ��_____ʱ��ֹͣ���ȡ�
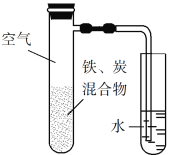
��4��ijͬѧ����ͼ��ʾ��ʵ��װ����ȡ������������ͨ���κ���±�С�
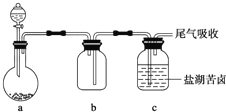
װ��b��ʵ���е�������_____����������װ���е�a��b��Ϊ����ķ������ռ�װ�ã�װ��c������Ľ�������������ṩ��ҩƷ��������װ�û�������ȡ��������_____��
����NH3��Ũ��ˮ�ͼ�ʯ�ҡ� ����SO2��CuƬ��Ũ����
����NO��CuƬ��ϡ���� ������O2��MnO2��˫��ˮ
��������װ���е�a��b��ȡ���ռ�NO��Ӧ��װ��b��θĽ���_____��
���𰸡����� ������ƿ K2CO3 ȡ��ɫ��ҺD������BaCl2��Һ����û�а�ɫ��������SO42-�ѳ��� ������ �д����������� ��ֹ���� �� ��b��װ��ˮ
��������
���κ���±��Ũ��Һ��ȡҺ�壬Ҫ��Br-����Ϊ�嵥�ʣ�Ȼ����CCl4��ȡ���õ����CCl4��Һ������CCl4��Һ�壬���Բ�������ķ�����Ҫ�õ��ϴ������Ȼ��ؾ��壬���ȥ��������Ca2+��Mg2+��SO42-��Ca2+���Լ�K2CO3��Һʹ֮�γ�CaCO3��������ȥ��Mg2+���Լ���KOH��Һʹ֮�γ�Mg(OH)2��������ȥ��SO42-����ͨ������BaCl2��Һʹ֮�γ�BaSO4��������ȥ��Ϊ�˳����������ӣ������Լ����Թ���������BaCl2��ҺӦ����K2CO3֮ǰ���룬����������Ba2+�����ú�����CO32-��ȥ����������CO32-���������ӵ������ȥ��
��1���������Ǽ���������BaCl2��Һ��K2CO3��Һ��KOH��Һ��õ��������ѳ�������Һ���룬�ù��˵ķ�������ɫҺ�������CCl4�Ļ���Ҫ���з�����壬����������ķ����������������Ҫ����������������ƿ���ƾ��ơ��¶ȼơ������ܡ�ţ�ǹܡ���ƿ���ʴ�Ϊ�����ˣ�������ƿ��
��2�����Լ�X��BaCl2��Һ��Y��KOH��Һ�����Լ�Z��K2CO3��Һ���ܺ�Ca2+��Ba2+���ɰ�ɫ�����Ӷ���ȥCa2+��Ba2+��SO42-�ܺ�Ba2+���ɰ�ɫ�������ʼ���SO42-�ѳ����ķ�����ȡ��ɫ��ҺD������BaCl2��Һ����û�а�ɫ��������SO42-�ѳ������ʴ�Ϊ��K2CO3��ȡ��ɫ��ҺD������BaCl2��Һ����û�а�ɫ��������SO42-�ѳ�����
��3���������������Ȼ�����Һ�õ��Ȼ��ؾ��壬���������������Ȼ�����Һ��ͬʱ�ò��������Ͻ��裬ֱ�����ִ�������ʱ��ֹͣ���ȣ��������Ƚ�ʣ���ˮ�����ɡ��ʴ�Ϊ���������д�������������
��4������ͼ��ʾ��ʵ��װ����ȡ������������b�Ľ����̶ܶ������ܳ���������ֹ���������á���������װ���е�a��b��Ϊ����ķ������ռ�װ�ã�b�������ռ��ܶȱȿ���С�Ҳ��Ϳ����еijɷַ�Ӧ�����壬SO2��O2���ܶȱȿ�����NO���ԺͿ����е�������Ӧ���ʶ�������bװ���ռ���ֻ�а�������Ҫ�����������װ���е�a��b��ȡ���ռ�NO������NO������ˮ��������b��װ��ˮ����ˮ���ռ�NO���ʴ�Ϊ���٣���b��װ��ˮ��