题目内容
【题目】含硫化合物在生活和生产中有着重要应用,科学使用含硫化合物对人体健康及环境保护意义重大。
(1)葡萄酒中添加微量的SO2可抑制细菌生长,防止葡萄酒被__(填“氧化”、“还原”)。
(2)氢的硫化物有多种:H2Sx(x=1,2,3,…),如H2S2,其结构与H2O2相似。请写出H2S3的结构式__。
(3)固体硫酸氢钾在加热熔化时,生成了焦硫酸钾(K2S2O7),反应中断裂的化学键类型为__。
(4)淮北某课题小组对连二亚硫酸钠(Na2S2O4)进行了如下探究。将0.050ml·L-1Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示(忽略溶液体积的变化)。
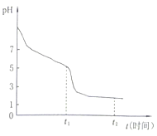
①Na2S2O4溶液显__性,原因是__(用离子方程式表示)。
②t1时溶液中只有一种溶质,此时含硫元素的粒子浓度由大到小的顺序为___。
0-t1段发生反应的离子方程式为__,t1-t2段溶液的pH变小的原因是__(用离子方程式表示)。
【答案】氧化 ![]() 离子键、共价键 碱 S2O42-+H2O=HS2O4-+OH-,HS2O4-+H2O=H2S2O4+OH- c(HSO3-)>c(SO32-)>c(H2SO3) 2S2O42-+O2+2H2O=4HSO3- 2HSO3-+O2=2H++2SO42-
离子键、共价键 碱 S2O42-+H2O=HS2O4-+OH-,HS2O4-+H2O=H2S2O4+OH- c(HSO3-)>c(SO32-)>c(H2SO3) 2S2O42-+O2+2H2O=4HSO3- 2HSO3-+O2=2H++2SO42-
【解析】
(1)葡萄酒中添加微量的SO2可抑制细菌生长,防止葡萄酒被氧化,故答案为:氧化;
(2)氢的硫化物有多种,其结构与H2O2相似,说明硫原子间形成一个单键两端和氢原子形成共价键,H2S3的结构式![]() ,故答案为:
,故答案为:![]() ;
;
(3)固体硫酸氢钾在加热熔化时,生成了焦硫酸钾(K2S2O7),一定破坏了离子键,酸根离子变化,证明生成了新的共价键,反应中断裂的化学键类型为:离子键、共价键,故答案为:离子键、共价键;
(4)①Na2S2O4溶液中溶质为强碱弱酸盐,溶液中S2O42-离子分步水解,溶液显碱性,水解离子方程式:S2O42-+H2O=HS2O4-+OH-,HS2O4-+H2O=H2S2O4+OH-,故答案为:碱;S2O42-+H2O=HS2O4-+OH-,HS2O4-+H2O=H2S2O4+OH-;
②t1时溶液中只有一种溶质,Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,溶液显酸性,说明亚硫酸氢根离子电离程度大于其水解程度,溶液中含硫元素的粒子浓度由大到小的顺序为:c(HSO3-)>c(SO32-)>c(H2SO3),0-t1段发生反应的离子方程式为:2S2O42-+O2+2H2O=4HSO3-,t1-t2段溶液的pH变小的原因是:亚硫酸氢钠被氧化生成硫酸氢钠,反应的离子方程式:2HSO3-+O2=2H++2SO42-,故答案为:c(HSO3-)>c(SO32-)>c(H2SO3);2S2O42-+O2+2H2O=4HSO3-;2HSO3-+O2=2H++2SO42-。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案