题目内容
(9分)(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。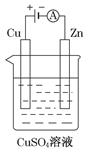
①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
(1)N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1 (2分)
(2)O2+2H2O+4e-=4OH- (2分) N2H4+4OH--4e-=4H2O+N2↑ (2分)
(3)①Cu2++2e-=Cu (1分) ②112 (2分)
解析试题分析:(1)1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),则1molN2H4即32g在氧气中完全燃烧生成氮气和H2O,放出19.5kJ×32=624 kJ热量,因此表示N2H4燃烧热的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1。
(2)原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应,因此该原电池中正极反应式为O2+2H2O+4e-=4OH-,负极是肼失去电子,电极反应式为N2H4+4OH--4e-=4H2O+N2↑。
(3)①锌与电源的负极相连,作阴极,溶液中的铜离子放电,电极反应式为Cu2++2e-=Cu。
②铜片质量变化为128g,即电解128g铜时失去电子的物质的量是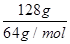 ×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
考点:考查热化学方程式书写以及电化学原理的应用

 一课一练课时达标系列答案
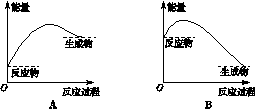
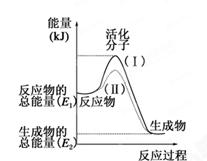
一课一练课时达标系列答案化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是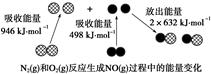
| A.1molN2(g)和NA个O2(g)反应放出的能量为180kJ |
| B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A.金刚石与石墨互为同位素 |
| B.石墨不如金刚石稳定 |
| C.金刚石与石墨互为同分异构体 |
| D.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ/mol
② CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ/mol
下列说法正确的是
| A.CH3OH的燃烧为吸热反应 |
B.反应①中的能量变化如图所示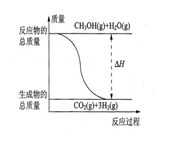 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H >-192.9kJ/mol |
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用。
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式
(2)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe2O3(s) 3CO2(g)+ 2Fe(s) △H<0
3CO2(g)+ 2Fe(s) △H<0
①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, 。
| A.容器中Fe2O3的质量不随时间而变化 | B.反应物不再转化为生成物 |
| C.n (CO) :n (CO2) = 1:1 | D.容器中气体的压强不随时间而变化 |
 CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol; (g)
(g) (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。
 CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .