题目内容
【题目】下图中的实验装置可用于制取乙炔。
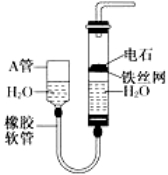
请填空:
(1)图中,A管的作用是____________,制取乙炔的化学方程式是______________。
(2)实验时常滴加饱和食盐水而不直接滴加水,其目的是________________,为了除去反应后的气体杂质,常选用___________试剂。
(3)乙炔通入溴的CCl4溶液中观察到的现象是_____________,乙炔发生了________反应。
【答案】(1)调节水面高度以控制反应的发生和停止 CaC2+2H2O→Ca(OH)2+C2H2↑
(2)减缓电石与水的反应速率 硫酸铜溶液或氢氧化钠溶液
(3)溴的CCl4的溶液褪色 加成
【解析】
试题分析:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止。制取乙炔的化学反应方程式为CaC2 + 2H2O→Ca(OH)2 + C2H2↑;
(2)电石与水反应很剧烈,因此为减缓电石与水的反应速率,实验时常滴加饱和食盐水而不直接滴加水;生成的乙炔中含有杂质H2S等,常用硫酸铜溶液或氢氧化钠溶液除杂;
(3)乙炔能够和溴水发生加成反应,因此乙炔通入溴的CCl4溶液中观察到的现象是溴的四氯化碳溶液褪色。

【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是___________,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是_____________,最高价氧化物水化物显两性的氢氧化物的化学式是_____________。
(2)③与④的气态氢化物的稳定性由大到小的顺序是_____________。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)①、③形成的阳离子的电子式是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。


