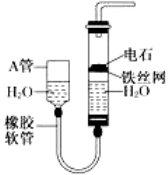
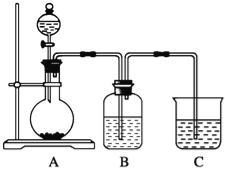
题目内容
【题目】若NA表示阿佛加德罗常数,下列说法正确的是:
A. 14 g 氮气中含有7NA个电子
B. 1 mol Cl2作为氧化剂得到的电子数为NA
C. 标准状况下,2. 24 L的CCl4中含有的C—Cl键数为0. 4NA
D. 常温常压下,3. 0 g含甲醛的冰醋酸中含有的原子总数为0. 4NA
【答案】AD
【解析】A. 14g氮气中含有氮原子的物质的量是14g÷14g/mol=1mol,其中含有7NA个电子,A正确;B. 1molCl2作为氧化剂得到的电子数不一定为NA,例如与铁反应得到2mol电子,B错误;C. 标准状况下四氯化碳是液体,不能利用气体摩尔体积计算物质的量,C错误;D. 甲醛和乙酸的最简式相同,均是CH2O,所以常温常压下,3.0 g含甲醛的冰醋酸中含有的原子总数为![]() =0.4NA,D正确,答案选AD。
=0.4NA,D正确,答案选AD。

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】下面是元素周期表的一部分,参照元素①~⑧在表中的位置,请用化学用语回答下列问题:
周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)④、⑤、⑧三种元素中,离子半径大小的顺序为__>__>__(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸酸性由强到弱的顺序是(填化学式)___>__>__。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为________________。
(4)能说明⑧的非金属性比⑨的非金属性________(填“强”或“弱”)的事实是: _________________(用离子方程式说明)。
(5)①和③形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的电子式___________,实验室中可用次氯酸钠溶液与氨反应制备甲,反应的化学方程式为___________________,甲可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,理论上1kg的甲可除去水中溶解的O2________kg。
(6)常温下,由①②组成10电子的化合物乙可作为燃料电池的原料之一,请写出乙在碱性介质中的电极反应式:正极:____________________;负极_______________________。