题目内容
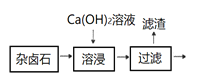
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)在水中存在如下平衡K2SO4MgSO42CaSO42H2O (s)![]() 2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:
2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:
(1)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高①________________;②______________。

(2)为了提高浸出效率,可采取的措施是:________;过滤用到的玻璃仪器名称是:______。
(3)滤渣主要成分有_________和_________以及未溶杂卤石,用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石、浸出K+的原因: _________________________________。
(4) 溶浸与分离过滤后,滤液中的主要杂质离子是______,进一步“除杂”环节见下图。可先加入______溶液,经搅拌等操作后,过滤,再加入_________溶液调滤液pH至中性。
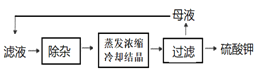
(5)中过滤得到的母液中含有大量的_____(填写化学式),检验其中溶质阴离子的方法是____________。
【答案】在同一时间K+的浸出浓度大 反应的速率加快,达到平衡所需溶浸时间短 将杂卤石粉碎、加热、搅拌 漏斗、烧杯、玻璃棒 CaSO4 Mg(OH)2 氢氧根离子与镁离子结合,使平衡不断向右移动,杂卤石溶解、K+变多 Ca2+、OH- K2CO3 H2SO4 K2SO4 取样少许, 滴几滴氯化钡溶液,再加入少量盐酸,如果有沉淀产生且不溶解,说明含有硫酸根离子
【解析】
由K2SO4MgSO42CaSO42H2O(s)![]() 2Ca2++2K++Mg2++4SO42-+2H2O及实验流程可知,加氢氧化钙溶液,过滤分离出滤渣为CaSO4、Mg(OH)2,结合图2可知,373K时K+的浸出浓度大,则滤液中大量的K2SO4,升高温度可提高浸出效率,除杂时加K2CO3除去钙离子,后加硫酸中和至中性,然后蒸发浓缩、冷却结晶、过滤分离出硫酸钾,以此来解答。
2Ca2++2K++Mg2++4SO42-+2H2O及实验流程可知,加氢氧化钙溶液,过滤分离出滤渣为CaSO4、Mg(OH)2,结合图2可知,373K时K+的浸出浓度大,则滤液中大量的K2SO4,升高温度可提高浸出效率,除杂时加K2CO3除去钙离子,后加硫酸中和至中性,然后蒸发浓缩、冷却结晶、过滤分离出硫酸钾,以此来解答。
(1)由图可知不同温度下,K+的浸出浓度与溶浸时间的关系,温度越高K+的浸出浓度越大,溶浸时间越短,反应速率越大,达到平衡越快,故结论为:温度越高,在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短;
(2)为了提高浸出效率,可采取的措施是升高温度;过滤用到的玻璃仪器名称是:烧杯、漏斗、玻璃棒;
(3)由上述分析可知,滤渣主要成分有CaSO4和Mg(OH)2以及未溶杂卤石,用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石、浸出K+的原因加入氢氧化钙溶液后氢氧根离子和镁离子结合生成氢氧化镁沉淀,促进平衡右移,K+增多;
(4)图1中过滤后,滤液中的主要杂质离子是Ca2+,进一步“除杂”环节见3,可先加入K2CO3除Ca2+,过滤后加入H2SO4,除去K2CO3,调滤液pH至中性;
(5)图3中过滤得到的母液中含有大量的K2SO4,检验其中溶质阴离子的方法是取少量母液,先向其中加足量盐酸酸化,然后再加BaCl2溶液,看是否产生白色沉淀,如果有沉淀产生且不溶解,说明含有SO42-。

【题目】将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO | H2O | CO2 | |||
1 | 650 | 4 | 2 | 1.6 | 5 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 2 | 1 | 0.4 | 1 | |
下列说法不正确的是
A. 该反应的正反应为放热反应
B. 实验1中,前5min用CO表示的速率为0.16 mol/(L·min)
C. 实验2中,平衡常数K=1/6
D. 实验3跟实验2相比,改变的条件可能是温度