题目内容
下列判断正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.C、Si和Ge的最外层电子数都是4,次外层电子数都是8
C.若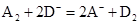 ,则氧化性:A2 > D2
,则氧化性:A2 > D2
D.CO2和SiO2都是酸性氧化物,都不能和氧化钙反应
C
解析试题分析:A、硫蒸气能量高,所以等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,错误;B、C原子的次外层电子数为2.错误;C、氧化还原反应的氧化性,氧化剂大于氧化产物,所以氧化性:A2 > D2,正确;D、CO2和SiO2是酸性氧化物,CaO为碱性氧化物,酸性氧化物和碱性氧化物反应生成盐,所以CO2、SiO2都可以和CaO反应。
考点:本题考查化学反应的热量变化、电子排布、氧化还原反应。

 阅读快车系列答案
阅读快车系列答案常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解 19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列有关分析错误的是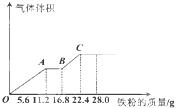
| A.原混合酸中NO3—的物质的量为0.2 mol |
| B.原混合酸中H2SO4物质的量浓度为2 mol/L |
| C.取25mL原混合酸加水稀释至1 L后溶液的pH =1 |
| D.OA段与BC段反应中电子转移的物质的量之比为3:1 |
硝酸盐不稳定,一般受热分解会放出氧气,下列硝酸盐分解可能不会产生氧气的是
| A.硝酸钠 | B.硝酸亚铁 | C.硝酸铵 | D.硝酸铜 |
实验室常利用以下反应制取少量氮气:NaNO2 + NH4Cl =" NaCl" + N2↑ + H2O关于该反应的下列说法不正确的是( )
| A.NaNO2的氧化性大于N2 |
| B.每生成1mol N2,转移的电子数的物质的量为6mol |
| C.NH4Cl的还原性大于N2 |
| D.氮元素既被氧化又被还原 |
下列物质溶于水,不发生氧化还原反应的是
| A.NO2溶于水 | B.Na2O2溶于水 | C.Cl2溶于水 | D.CaO溶于水 |
下列变化,需要加入还原剂才能实现的是
| A.FeCl2→FeCl3 | B.CO2→C | C.NaAlO2→AlCl3 | D.HCl→Cl2 |
将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)="0.1" mol/L,则下列叙述中错误的是( )
| A.反应中消耗的Zn的质量为97.5 g |
| B.气体A中SO2和H2的体积比为1∶4 |
| C.反应中被还原的元素只有一种 |
| D.反应中共转移电子3 mol |
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是(双选 ( )。
| A.在该反应中碘酸钠作氧化剂 |
| B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性 |
| C.反应中生成1 mol Na2H3IO6转移2 mol电子 |
| D.反应中氧化产物与还原产物的物质的量之比为2∶1 |