题目内容
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为___________________。
(2)稼氮砷合金材料的太阳能电池效率达40%,Ga、N、As电负性由大至小的顺序是__________________
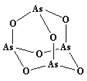
(3)As4O6的分子结构如右图所示,其中As原子的杂化方式为___________________,1 mol As4O6含有σ键的物质的量为_______________。
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示。则Y轴可表示的氢化物(RH3)性质可能是 。
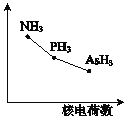
A.稳定性 | B.沸点 | C.R-H键能 | D.分子间作用力 |
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是
【答案】(1)[Ar]3d104s24p3;
(2)N>As>Ga;
(3)sp3 ;12mol;
(4)ac;
(5)NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键;
【解析】试题分析:(1)As为35号元素,基态As原子的核外电子排布式为[Ar]3d104s24p3,故答案为:[Ar]3d104s24p3;
(2)元素的非金属性越强,电负性越大,Ga和As同周期,Ga<As,N和As同主族,N>As,电负性由大至小的顺序是N>As>Ga,故答案为:N>As>Ga;
(3)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化,根据As4O6的分子结构,1 mol As4O6含有σ键的物质的量为12mol,故答案为:sp3 ;12mol;
(4)A.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,A正确;B.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高,故B错误;C.非金属性越强与氢元素形成的共价键越强,键能越大,因此R-H键能随原子序数的增大而减小,故C正确;D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,故D错误;故答案为:AC;
(5)NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键,使得AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,故答案为:NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键。

 小学课时特训系列答案
小学课时特训系列答案