题目内容
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)A、B、C三种元素的名称分别为________、________、________。
(2)B位于元素周期表中第________周期,第________族。
(3)C的单质与H2反应的化学方程式为_________
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式________
【答案】 氮 硫 氟 三 ⅥA F2+H2![]() 2HF 2NH3+H2SO4
2HF 2NH3+H2SO4![]() (NH4)2SO4
(NH4)2SO4
【解析】A、B、C为短周期元素,根据元素在周期表中位置知,A和C位于第二周期、B位于第三周期,设B原子序数为x,则A原子序数为x-9、C原子序数为x-7,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等,则x-9+x-7=x,则x=16,所以B是S元素,则A是N元素、C是F元素。
(1)通过以上分析知,A、B、C分别是氮、硫、氟元素,故答案为:氮;硫;氟;
(2)B是S元素,S原子核外有3个电子层、最外层电子数是6,所以S元素位于第三周期第VIA族,故答案为:三;ⅥA;
(3)C为F元素,氟与H2反应的化学方程式为F2+H2=2HF,故答案为:F2+H2=2HF;
(4)A的气态氢化物为氨气,氨气与硫酸反应的化学方程式为2NH3+H2SO4=(NH4)2SO4,故答案为:2NH3+H2SO4=(NH4)2SO4。

【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为___________________。
(2)稼氮砷合金材料的太阳能电池效率达40%,Ga、N、As电负性由大至小的顺序是__________________
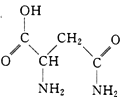
(3)As4O6的分子结构如右图所示,其中As原子的杂化方式为___________________,1 mol As4O6含有σ键的物质的量为_______________。
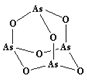
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示。则Y轴可表示的氢化物(RH3)性质可能是 。
A.稳定性 | B.沸点 | C.R-H键能 | D.分子间作用力 |
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是