��Ŀ����
����Ŀ��1100��ʱ�������Ϊ5L���ܱ������У��������淴Ӧ��Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)���ﵽƽ�⣬��������и��⣺
Na2S(s)+4H2O(g)���ﵽƽ�⣬��������и��⣺
��1��������Ӧ���漰�ķǽ���Ԫ��ԭ�ӵİ뾶�Ӵ�С��˳��Ϊ_____________���ǽ�������ǿ��Ԫ��ԭ�ӵĵ����Ų�ʽ_________________������ӵ�����������________�֡�
��2���÷�Ӧ��O��S����ͬ����Ԫ�أ��Ƚ����ǵĵ��ʵ�������_____________________���û�ѧ����ʽ��ʾ����д��Na2O�ĵ���ʽ______���Ƚ�Na2O��Na2S���۵�ߵͣ�Na2O___Na2S��
��3������ƽ���ƽ�ⳣ������ʽK��______________________�������¶ȣ�Kֵ��С��������ӦΪ_______(��������������������)��Ӧ��
��4�����жϷ�Ӧ�ﵽƽ��״̬��������_____________(�����)��
A����������ѹǿ���� B�����������ܶȲ���
C����������ƽ����Է����������� D���������Ũ�����
��5������ʼʱ�����Na2SO4Ϊ2.84g��10���Ӻ�ﵽƽ��ʱNa2SO4��ת����Ϊ45%��V(H2)=__________________��ƽ����������г���1molH2��ƽ����_________________����������Ӧ�����������淴Ӧ�������������ƶ����������´ﵽƽ�����ԭƽ����ȣ�H2������ٷֺ���_____________(����������������С������������)
���𰸡�S>O>H 1s22s22p4 2 2H2S+O2��2S+2H2O ![]() > [H2O]4/[H2]4 ���� BC 27.7.2��10-4mol/��L��min�� ����Ӧ���� ����
> [H2O]4/[H2]4 ���� BC 27.7.2��10-4mol/��L��min�� ����Ӧ���� ����
��������
(1)����Ԫ�������ɺ�����ԭ�����
(2)����ͬ����Ԫ�ش������·ǽ����Լ����������Լ����Ĺ��ɺ����Ӿ����۷е�仯���ɽ��
(3)���岻д��ƽ�ⳣ������ʽ�У�ƽ�ⳣ��K=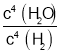 =
= �������¶ȣ�Kֵ��С��˵��ƽ��������У�
�������¶ȣ�Kֵ��С��˵��ƽ��������У�
(4)�ж�ƽ��ı�־��Ҫ�������������������������������Լ�����ƽ�����ԭ��������Ӧ�������淴Ӧ������ȣ�
(5)���ݷ�ӦNa2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)�е�ϵ����ϵ������V(H2)��������������ԭ��������Ӧ��Ũ�Ƚ�ʹ��ƽ�������������ƶ������ڸ÷�ӦΪ����ǰ�����������ȵķ�Ӧ�����ݵ�Чƽ����ص�ش�
Na2S(s)+4H2O(g)�е�ϵ����ϵ������V(H2)��������������ԭ��������Ӧ��Ũ�Ƚ�ʹ��ƽ�������������ƶ������ڸ÷�ӦΪ����ǰ�����������ȵķ�Ӧ�����ݵ�Чƽ����ص�ش�
(1)����ʽ�г��ֵ����ַǽ���Ԫ�طֱ�ΪH��O��S������Ԫ�������ɵ��Ӳ���Խ��뾶Խ��֪�뾶��СΪS>O>H���ǽ�����ǿ��ΪOԪ�أ����������Ϊ8����˸���ԭ�Ӻ�������Ų������֪1s22s22p4����������ԭ����֪����Ӧ����2�֣�
(2)����ͬ����Ԫ�ش������·ǽ����Լ����������Լ����Ĺ��ɣ���֪������������ǿ�����ʣ����2H2S+O2��2S+2H2O�ܳ��˵������֤��һ���ۣ�����ʽ��һ�ֱ�ʾ���ʽṹ�Ļ�ѧ������ʽ�������ĵ���ʽ��д��Ҫע�����ӻ������빲�ۼ�����д��Na2O�ĵ���ʽΪ��![]() �����Ӿ����У��������Ӱ뾶ԽС�������Խ�࣬���Ӽ�Խǿ���۷е�Խ�ߣ���֮Խ�ͣ��������ӵİ뾶С�������ӿ�֪��Na2O>Na2S��
�����Ӿ����У��������Ӱ뾶ԽС�������Խ�࣬���Ӽ�Խǿ���۷е�Խ�ߣ���֮Խ�ͣ��������ӵİ뾶С�������ӿ�֪��Na2O>Na2S��
(3) Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)�����岻д��ƽ�ⳣ������ʽ�У�ƽ�ⳣ��K=
Na2S(s)+4H2O(g)�����岻д��ƽ�ⳣ������ʽ�У�ƽ�ⳣ��K=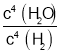 =
= �������¶ȣ�Kֵ��С��˵��ƽ��������У��淴Ӧ�����Ƿ��ȷ�Ӧ������Ӧ����Ϊ���ȷ�Ӧ��
�������¶ȣ�Kֵ��С��˵��ƽ��������У��淴Ӧ�����Ƿ��ȷ�Ӧ������Ӧ����Ϊ���ȷ�Ӧ��
(4)A. ��ӦNa2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)�������������ķ�Ӧ����Ӧ������ѹǿһֱ���䣬��������ѹǿ����ʱ����һ����ƽ��״̬����A����
Na2S(s)+4H2O(g)�������������ķ�Ӧ����Ӧ������ѹǿһֱ���䣬��������ѹǿ����ʱ����һ����ƽ��״̬����A����
B. ��ӦNa2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)�������������ķ�Ӧ�����������ܶȲ���ʱ��˵��������ˮ�������������ٱ仯��˵���ﵽƽ��״̬����B��ȷ��
Na2S(s)+4H2O(g)�������������ķ�Ӧ�����������ܶȲ���ʱ��˵��������ˮ�������������ٱ仯��˵���ﵽƽ��״̬����B��ȷ��
C. ��ӦNa2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)�����������ʵ�������ķ�Ӧ����������ƽ����Է�����������ʱ��˵��������ˮ�������������ٱ仯��˵���ﵽƽ��״̬����C��ȷ��
Na2S(s)+4H2O(g)�����������ʵ�������ķ�Ӧ����������ƽ����Է�����������ʱ��˵��������ˮ�������������ٱ仯��˵���ﵽƽ��״̬����C��ȷ��
D. �������Ũ�����ʱ������˵��������ˮ�������������ʵ������ٱ仯����һ����ƽ��״̬����D����
��ȷ����BC��
(5)����ʼʱ����Na2SO4���ʵ���Ϊ![]() =0.02mol�� 10���Ӻ�ﵽƽ��ʱNa2SO4��ת����Ϊ45%�����ݷ�ӦNa2SO4(s)+4H2(g)
=0.02mol�� 10���Ӻ�ﵽƽ��ʱNa2SO4��ת����Ϊ45%�����ݷ�ӦNa2SO4(s)+4H2(g)![]() Na2
Na2![]() =7.2��10-4mol/(L��min)��������������ԭ��������Ӧ��Ũ�Ƚ�ʹ��ƽ�������������ƶ������ڸ÷�ӦΪ����ǰ�����������ȵķ�Ӧ�����ݵ�Чƽ����ص㣬�����İٷֺ�����Ȼ���䡣
=7.2��10-4mol/(L��min)��������������ԭ��������Ӧ��Ũ�Ƚ�ʹ��ƽ�������������ƶ������ڸ÷�ӦΪ����ǰ�����������ȵķ�Ӧ�����ݵ�Чƽ����ص㣬�����İٷֺ�����Ȼ���䡣

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��������һ����Ҫ�Ļ���ԭ�ϡ��Ӵ��������������Ʒ��98�������ᡢ20���ķ������ᣨH2SO4��SO3�Ļ�������SO3����������Ϊ0.2����
������м��㣺
��1���������������̵���ģ�__________m3 SO2���ۺϳɱ�״���������ת�������գ��ɲ���1�� 98%�����ᣨ�ܶ�Ϊ1.84g/mL������98��������ɱ�ʾΪSO3![]() H2O��20���ķ�������ɱ�ʾΪSO3aH2O����a��ֵΪ ___________���÷�����ʾ����
H2O��20���ķ�������ɱ�ʾΪSO3aH2O����a��ֵΪ ___________���÷�����ʾ����
��2���������Ļ��������������������������Ҳ������Ҫ�����á����мס�����ƿ��ɫ��Һ����֪���ǿ�����Na[Al��OH��4]��Һ��H2SO4��Һ���־�ʵ�����������ݣ�
����֪��2Na[Al��OH��4]+H2SO4��2Al��OH��3��+Na2SO4+2H2O��
��� | �ף�mL�� | �ң�mL�� | ���������ʵ�����mol�� |
�� | 140 | 10 | 0.02 |
�� | 10 | 140 | 0.02 |
�� | 20 | 560 | 0.04 |
��ͨ����Ҫ�ļ����ƶϹ��̻ش�����Һ�е�������ʲô________�������ʵ���Ũ��Ϊ����________��