题目内容
下列装置不能完成实验的是 ( )
| | 装置 | 实验 | | 装置 | 实验 |
| A |  | 结合秒表测 量锌与硫酸 的反应速率 | C | 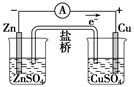 | 验证化学能 转化为电能 |
| B | 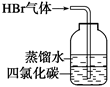 | 吸收多余 HBr气体 | D | 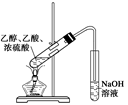 | 实验室制 取少量乙酸 乙酯 |
D
解析试题分析:A、通过时间和注射器活塞移动的快慢,定量测定化学反应速率,能达到实验目的;
B、溴化氢极易溶于水,直接插入水中容易造成倒吸。四氯化碳不溶于水,密度大于水,选项B中的装置可以实现;
C、该装置是原电池,可以验证化学能转化为电能;
D、该装置中用氢氧化钠溶液吸收,而氢氧化钠能和乙酸乙酯反应,所以不能制取,应该用饱和碳酸钠溶液吸收,答案选D。
考点:考查化学实验基本操作的正误判断
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
下列有关说法中,不正确的是
| A.除去Fe(OH)3胶体中少量的NaCl,常用渗析的方法 |
| B.实验室中少量金属钠、钾常保存在汽油中 |
| C.中和滴定时要将滴定管洗净并用待盛溶液润洗2~3次 |
| D.将盐酸、KSCN溶液和Fe(OH)3溶液混合后,溶液显红色 |
下列实验正确的是
| A.用量筒量取15.50mL 0.100 mol·L-1盐酸 |
| B.用无水酒精萃取碘水中的碘 |
| C.用过量浓氨水洗涤试管内的银镜 |
| D.做H2还原CuO实验时,要先通氢气,验纯后再加热 |
下列与实验相关的叙述中,正确的是 ( )
| A.将碘水倒入分液漏斗,再加适量苯,充分振荡、静置、过滤,可从碘水中获取碘 |
| B.从CuSO4溶液得到CuSO4·5H2O的操作是加热浓缩,冷却结晶 、过滤、洗涤、干燥 |
| C.室温下向滴有酚酞的NaOH溶液中滴加稀盐酸当红色恰好退去时所得溶液pH=7 |
| D.向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe2+ |
下列仪器中,可用酒精灯直接加热的是
| A.烧杯 | B.烧瓶 | C.锥形瓶 | D.坩埚 |
下列关于容量瓶及其使用方法的叙述,正确的是( )
①是配制一定物质的量浓度的溶液的专用仪器 ②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热 ④不能用容量瓶贮存配制好的溶液
⑤一定要用500mL容量瓶配制250mL溶液
| A.①③ | B.①②④ | C.①②④⑤ | D.①②③④ |
(16分)(1)下列有关实验操作或判断不正确的是 。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B.用干燥的pH试纸测定氯水的pH |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量 |
F.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
(2)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
| | 试剂 | 离子反应方程式 |
| ①NaHCO3溶液(Na2CO3) | | |
| ② Fe2O3(Al2O3) | | |
| ③FeCl3溶液(FeCl2) | | |
| ④CO2(HCl) | | |

 ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。