题目内容
下列与实验相关的叙述中,正确的是 ( )
| A.将碘水倒入分液漏斗,再加适量苯,充分振荡、静置、过滤,可从碘水中获取碘 |
| B.从CuSO4溶液得到CuSO4·5H2O的操作是加热浓缩,冷却结晶 、过滤、洗涤、干燥 |
| C.室温下向滴有酚酞的NaOH溶液中滴加稀盐酸当红色恰好退去时所得溶液pH=7 |
| D.向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe2+ |
B
解析试题分析:A、萃取后的操作是分液,表示过滤,A不正确;B、从CuSO4溶液得到CuSO4·5H2O的操作是加热浓缩,冷却结晶 、过滤、洗涤、干燥,B正确;C、酚酞的变色范围是8.2~10.0,所以当红色恰好退去时所得溶液pH>7,C不正确;D、该溶液中也可能含有铁离子,D不正确,答案选B。
考点:考查化学实验基本操作的正误判断、实验分析与评价等

练习册系列答案
相关题目
下列有关实验的叙述正确的是
| A.滴定管洗净后,直接注入标准液进行滴定 |
| B.某溶液先加入稀盐酸无明显现象,再加入BaCl2溶液产生白色沉淀,说明原溶液中含有SO42- |
| C.配制一定物质的量浓度的稀硫酸时,向容量瓶中加入适量的水,再缓缓注入事先量取的浓硫酸 |
| D.某气体能使湿润的蓝色石蕊试纸变为红色,则该气体为氨气 |
关于下列图示的说法中,正确的是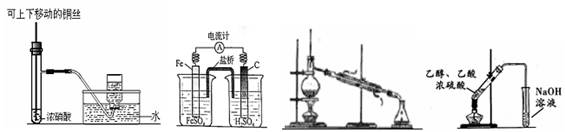
图1 图2 图3 图4
| A.图1制备并收集少量NO2气体 |
| B.图2是原电池装置,Fe电极为负极 |
| C.图3常用于分离互不相溶的液体 |
| D.图4可用于实验室制取和收集乙酸乙酯 |
下列说法不正确的是
| A.燃着的酒精灯不慎碰翻失火,应该迅速用湿抹布扑盖 |
| B.用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量。 |
| C.制备摩尔盐的过程中,洗涤硫酸亚铁铵晶体时,应用少量酒精洗去晶体表面附着的水分 |
| D.在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化 |
下列操作会导致实验结果偏高的是
| A.用天平称量20.5g某物质。砝码和药品的位置放反,所得药品的质量 |
| B.测定Na2CO3溶液的pH时先将pH试纸润湿了再测定,所测得的pH值 |
| C.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度 |
| D.酸式滴定管在盛装标准溶液前没有用标准溶液润洗,测得的待测液浓度 |
下列装置不能完成实验的是 ( )
| | 装置 | 实验 | | 装置 | 实验 |
| A |  | 结合秒表测 量锌与硫酸 的反应速率 | C |  | 验证化学能 转化为电能 |
| B |  | 吸收多余 HBr气体 | D |  | 实验室制 取少量乙酸 乙酯 |
下列装置或操作与实验目的最相符的是
| A.①—实验室制取并收集足量NH3 |
| B.②—以溴化钾、90%硫酸、乙醇为原料合成溴乙烷的装置 |
| C.③—检查装置气密性 |
| D.④—利用排空气法收集CO2 |
某化学小组的同学到实验室学习。在实验桌上摆有如图所示仪器:
(1)指导教师要求同学们写出仪器的名称,某同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则此空不需要填写)。
| 仪器编号 | a | b | c | d | e |
| 名称 | 试管 | 溶量瓶 | 集气瓶 | 碱式滴定管 | 普通漏斗 |
| 改正的名称 | | | | | |
(2)甲同学想用d进行实验,请你说出该仪器(已经洗涤干净)使用时的第一步操作: 。
(3)关于e的用途,乙同学说可组成防倒吸装置。你还能说出其他两种用途吗?
① ;
② 。
(4)丙同学想用如图所示装置用大理石和稀盐酸反应制取CO2。老师指出,这需要太多的稀盐酸,会造成浪费,该同学选用了上面的一种仪器,加在装置中,解决了这个问题。请你把该仪器画在图中合适的位置。

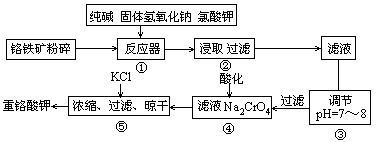
 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。