题目内容
加热3.24 g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为2.51 g。计算原混合物中碳酸钠的质量分数。
Na2CO3的质量分数为38.9%。
加热混合物时,由于碳酸氢钠分解,产生的二氧化碳和水蒸气从体系中排出,使反应混合物质量减少3.24 g-2.51 g="0.73" g,产生差量的有关物质是二氧化碳和水蒸气。
设混合物中碳酸氢钠的质量为x,则:
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
2×84=168 18+44=62
x 0.73 g
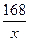 =
=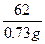 ,x=1.98 g。
,x=1.98 g。
碳酸钠的质量分数是:
w(Na2CO3)=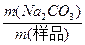 ×100%
×100%
=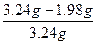 ×100%=38.9%。
×100%=38.9%。
设混合物中碳酸氢钠的质量为x,则:
2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑2×84=168 18+44=62
x 0.73 g
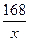 =
=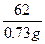 ,x=1.98 g。
,x=1.98 g。碳酸钠的质量分数是:
w(Na2CO3)=
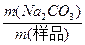 ×100%
×100%=
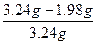 ×100%=38.9%。
×100%=38.9%。
练习册系列答案
相关题目
 溶液的反应,同学们观察到该反应中生成了蓝色的Cu(OH)
溶液的反应,同学们观察到该反应中生成了蓝色的Cu(OH) 沉淀而没有发现铜单质生成。但某同学想:会不会因生成的铜较少被蓝色沉淀所覆盖,而没有被发现呢?于是他想课后到实验室继续研究,希望进一步用实验来验证自己的猜测是否正确。
沉淀而没有发现铜单质生成。但某同学想:会不会因生成的铜较少被蓝色沉淀所覆盖,而没有被发现呢?于是他想课后到实验室继续研究,希望进一步用实验来验证自己的猜测是否正确。