题目内容
2.已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,根据化学方程式:N2+3H2 $\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$2NH3.1mol N2反应放出的热量 为92.4kJ•mol-1那么N≡N键的键能是( )| A. | 431 kJ•mol-1 | B. | 945.6 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 896 kJ•mol-1 |
分析 根据反应热△H=反应物的总键能-生成物的总键能,以此解答.
解答 解:已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,令N≡N的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反应热△H=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,
解得:x=945.6 kJ/mol,
故选:B.
点评 本题考查反应热的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,难度中等,掌握反应热与键能的关系是关键.

练习册系列答案
相关题目
10.化学是人类利用自然资源、丰富物质世界的重要科学依据.下列说法不正确的是( )
| A. | 我国许多城市已经推广使用清洁燃料以减少环境污染,如压缩天然气(CNG)、液化石油气(LPG),这两类燃料的主要成分均是烃类 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 当今,实现煤的综合利用的主要途径是通过煤的干馏、煤气化和煤液化而获得洁净的燃料和多种化工原料 | |
| D. | 工业上利用金属活泼性不同,采用不同的冶炼方法冶炼金属,如电解法冶炼铝、热还原法冶炼铁、热分解法冶炼铜 |
17.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键 范德华力 非极性键 | B. | 氢键 氢键 极性键 | ||
| C. | 氢键 极性键 范德华力 | D. | 范德华力 氢键 非极性键 |
7.下列图示实验正确的是( )
| A. | 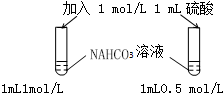 探究浓度对化学反应速率的影响 | B. | 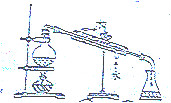 分离乙醇和乙酸的混合溶液 | ||
| C. | 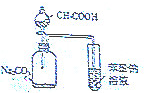 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 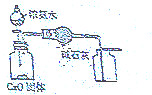 制取并且收集干燥纯净的NH3 |
14.我国最新报道的高温超导体中,铊(Ti)是组成的成分之一,已知铊与铝是同族元素,关于铊的性质的判断可能错误的是( )
| A. | 是银白色、质软的金属 | |
| B. | 阳离子氧化性比铝离子强 | |
| C. | 加热蒸干TiCl3溶液可得到无水TiCl3 | |
| D. | 与稀硝酸作用生成硝酸盐 |
1.下列有关实验的叙述,正确的是( )
| A. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| B. | 制备乙酸乙酯时,加料顺序为浓硫酸、乙醇、乙酸 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 | |
| D. | 实验室可用苯和溴水在Fe作催化剂的情况下制备溴苯 |
