题目内容
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化的PbO2、还有组成类似Fe3O4的Pb3O4 ,请将Pb3O4 改写成简单氧化物的形式: _________。
II.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO 、PbO2、PbSO4等)为原料,制备超细PbO ,实现铅的再生利用。其工作流程如下:
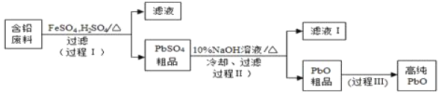

(2)步骤① 的目的是“脱硫”,即将PbSO4转化PbSO3,反应的离子方程式为_______________________。
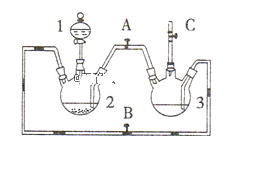
“脱硫过程”可在如图所示的装置中进行,实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h.。
①仪器a的名称是 __________;转化温度为35 ℃, 采用的合适加热方式是________。
②步骤②中H2O2的作用是 __________________ (用化学方程式表示)。
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A _____________(填装置字母代号),证明产物中有CO气体的实验现象是________________。

(4)测定草酸铅样品纯度:称取2.5g样品,酸溶后配制成250mL溶液,然后量取25.00mL该溶液,用0.05000molL-1的EDTA(Na2H2Y)标准溶液滴定其中的Pb2+ (反应方程式为Pb2++H2Y2-= PbY2- +2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14.52mL
①若滴定管未用 EDT A 标准液润洗,测定结果将_________ (填“偏高” “偏低” 或“不变”)。
②草酸铅的纯度为 __________(保留四位有效数字)。
【答案】2PbOPbO2 CO32— +PbSO4 = SO42—+PbCO3 三颈(口)烧瓶 热水浴 PbO2+H2O2+2HNO3 =Pb(NO3)2+2H2O+O2↑ BCBDEBF E中黑色粉未变为红色、其后的B中澄清石灰水变混浊 偏高 85.67%
【解析】
I.(1)Pb在化合物中的化合价有+2价、+4价,改写氧化物时要遵循化合价不变、原子守恒,据此书写;
Ⅱ.铅膏废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,铅膏中加入碳酸铵目的是“脱硫”,即将PbSO4转化为PbCO3,过氧化氢和稀硝酸还原PbO2生成硝酸铅溶解,脱硫、浸取、氧化反应过滤得到滤液中加入草酸钠溶液过滤,得到草酸铅沉淀,550°C煅烧得到超细PbO,草酸铅受热分解生成PbO时,还有CO和CO2生成,检验这两种气体,需要先检验二氧化碳,然后除去二氧化碳,在将CO转化为二氧化碳检验CO,据此分析解答。
I.(1)Pb在化合物中的化合价有+2价、+4价,则Pb3O4写成两种氧化物的形式为2PbOPbO2,故答案为:2PbOPbO2;
Ⅱ.(2)步骤①的目的是“脱硫”,将PbSO4转化为溶解度更小的PbCO3,沉淀转化的离子方程式为:CO32-+PbSO4=SO42-+PbCO3,故答案为:CO32-+PbSO4=SO42-+PbCO3;
①根据图示,仪器a为三颈烧瓶,转化温度为35℃,采用的合适加热方式为水浴加热,故答案为:三颈烧瓶;水浴加热;
②步骤②中H2O2的作用是在酸性条件下还原PbO2生成硝酸铅,反应的化学方程式为:PbO2+H2O2+2HNO3=Pb(NO3)2+2H2O+O2↑,故答案为:PbO2+H2O2+2HNO3=Pb(NO3)2+2H2O+O2↑;
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,利用A加热分解草酸铅,装置B检验二氧化碳的生成,通过装置C除去二氧化碳,装置B检验二氧化碳是否除净,通过D装置吸收水蒸气,通过E装置加热一氧化碳和氧化铜反应生成铜和二氧化碳,通过B装置检验生成的二氧化碳存在,最后排水法收集气体,依次连接的合理顺序为ABCBDEBF,证明生成一氧化碳的实验现象E中黑色粉末变为红色,其后的B中澄清石灰水变浑浊,故答案为:BCBDEBF;E中黑色粉末变为红色,其后的B中澄清石灰水变浑浊;
(4)①滴定管未用EDTA标准溶液润洗,内层水膜会稀释标准溶液,导致消耗的标准溶液的体积偏大,测定结果偏高,故答案为:偏高;
②取2.5g样品,酸溶后配制成250mL溶液,然后量取25.00mL该溶液,用0.05000mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Pb2+反应方程式为 H2Y2-+Pb2+=PbY2-+2H+,(杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14.52mL,则消耗EDTA的物质的量=0.01452L×0.0500mol/L=7.26×10-4mol,根据Pb2++H2Y2-=PbY2-+2H+,结合Pb守恒有n(PbC2O4)=n( Pb2+)=7.26×10-4mol,250mL溶液中n(PbC2O4)=7.26×10-4mol×![]() ,草酸铅的纯度=
,草酸铅的纯度= ×100%=85.67%,故答案为:85.67%。
×100%=85.67%,故答案为:85.67%。

 备战中考寒假系列答案
备战中考寒假系列答案