题目内容
【题目】Ⅰ、常温下,将0.1 mo1/L CH3COONa和0.05 mo1/L HCl等体积混合溶液呈酸性(忽略混合过程中体积变化)。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表达_______________________、_______________________、______________________。
(2)该溶液中,浓度为0.05 mol/L的粒子是_____(填离子符号)。c(Cl-)、c(CH3COO-)、c(CH3COOH)三种离子浓度由大到小的关系是__________________。
Ⅱ、现有浓度为0.1 mol/L的四种电解质溶液①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa。已知:CO2 + 3H2O + 2A1O2- = 2Al(OH)3↓ + CO32-
(1)这四种溶液的pH由小到大的顺序是:______________(填编号);
(2)在上述四种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是:________(填编号);
(3)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式:________________________________。
【答案】H2O ![]() H+ + OH- CH3COOH
H+ + OH- CH3COOH ![]() CH3COO- + H+ CH3COO- + H2O
CH3COO- + H+ CH3COO- + H2O ![]() CH3COOH + OH- Na+ c(CH3COO-) > c(Cl-) > c(CH3COOH) ④<②<①<③ ①、② AlO2- + HCO3- + H2O = Al(OH)3↓ + CO32-
CH3COOH + OH- Na+ c(CH3COO-) > c(Cl-) > c(CH3COOH) ④<②<①<③ ①、② AlO2- + HCO3- + H2O = Al(OH)3↓ + CO32-
【解析】
根据溶液的酸碱性,判断电离与水解的主次;根据复分解反应规律,比较酸碱性的强弱。
I、0.1 mo1/L CH3COONa和0.05 mo1/L HCl等体积混合时,发生反应CH3COONa+HCl=CH3COOH+NaCl,所得混合溶液中CH3COONa、CH3COOH、NaCl各0.025 mo1/L。
(1)该溶液中存在的平衡体系有:CH3COOH的电离CH3COOH ![]() CH3COO- + H+、CH3COONa的水解CH3COO- + H2O
CH3COO- + H+、CH3COONa的水解CH3COO- + H2O ![]() CH3COOH + OH-、水的电离H2O
CH3COOH + OH-、水的电离H2O ![]() H+ + OH-。
H+ + OH-。
(2)该溶液中,CH3COONa、NaCl完全电离,CH3COOH微弱电离,使c(Na+)=0.05 mol/L、c(Cl-)=0.025 mol/L、c(CH3COO-)+c(CH3COOH)=0.05 mol/L。因混合溶液呈酸性,CH3COOH电离程度大于CH3COO-的水解程度,得c(CH3COO-)>0.025 mol/L>c(CH3COOH),即c(CH3COO-) > c(Cl-) > c(CH3COOH)。
II、复分解反应中,较强酸+较弱酸盐→较强酸盐+较弱酸。由已学知识和已知反应可得,酸性(电离H+的能力,用Ki表示):CH3COOH>H2CO3>HCO3->Al(OH)3,根据盐类水解规律:越弱越水解,则对应盐的水解能力(结合H+的能力,用水解常数表示):CH3COO-<HCO3-<CO32-<AlO2-。
(1)浓度相同时pH:④CH3COONa<②NaHCO3<①Na2CO3<③NaAlO2。
(2)AlCl3溶液与①Na2CO3、②NaHCO3、③NaAlO2的双水解反应都能进行完全,但只有①Na2CO3、②NaHCO3中能产生大量无色无味的CO2气体;
(3)据复分解反应规律,②NaHCO3与③NaAlO2能发生反应,离子方程式为AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-。

 黄冈天天练口算题卡系列答案
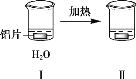
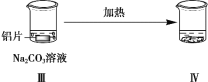
黄冈天天练口算题卡系列答案【题目】探究铝片与Na2CO3溶液的反应。
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
下列说法不正确的是
A. Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH-
B. 对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C. 推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D. 加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
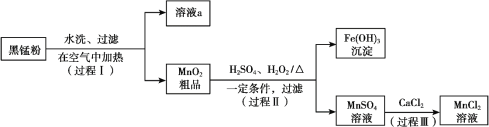
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。
① 溶液a呈酸性,原因是______。
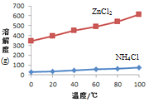
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。