题目内容
【题目】二氧化碳的捕集、利用与封存是我国能源领域的一个重要战略方向,发展成一项重要的新兴产业。
(1)已知:CH4、CO、H2的燃烧热分别为890 kJmol-1、283 kJmol-1、285.8 kJmol-1,计算下列反应的反应热。CO2(g)+CH4(g)= 2CO(g)+ 2H2(g) ΔH=____kJmol-1。
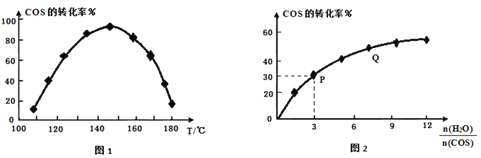
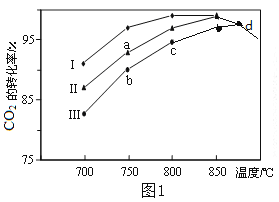
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2![]() CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①该反应的ΔH______0(填“>”或“<”)
②d点不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下CO2的转化率相同的原因是_______________。
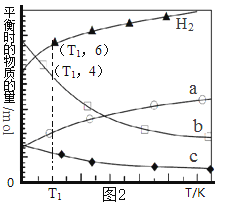
(3)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2)∶n(CO2)=3∶1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
①该反应在__________自发进行(填“低温”或“高温”)。
②c代表的物质是_______________。
③T1温度下的平衡转化率为__________________,相对于起始状态,平衡时气体的平均相对分子质量增大的百分率为_______________(保留三位有效数字)。
【答案】+247.6<d均达到平衡状态,催化剂不影响平衡转化率低温C2H450%23.1%
【解析】试题分析:本题为化学反应原理综合测试题,为高考必考题型,题目难度较大。考查点涉及反应热的计算、盖斯定律,化学平衡图像分析和化学平衡计算。
(1)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:①O2(g)+2H2(g)=2H2O(l)△H=-571.6 kJmol-1;②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJmol-1;③2CO(g)+O2(g)=2CO2(g)△H=-566 kJmol-1mol-1,利用盖斯定律将②-①-③可得CO2(g)+CH4(g)= 2CO(g)+ 2H2(g) ΔH=+247.6kJmol-1。
(2)分析图1知a、b、c点均未达到平衡状态,升高温度,化学反应速率加快,CO2的转化率增大;d点不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下均达到平衡状态。①d点不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下均达到平衡状态,在升高温度,CO2的转化率逐渐减小,平衡逆向移动,该反应的正反应为放热反应,ΔH<0;②使用催化剂只能改变反应速率,平衡不移动,不影响CO2的平衡转化率。
(3)①反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)正向为气体物质的量减小的反应,△S<0,由图2知随着温度的升高,平衡时H2的物质的量逐渐增大,平衡逆向移动,则该反应为放热反应,△H <0,根据△H-T△H<0判断该反应在低温自发进行。 ②分析图2知随着温度的升高,平衡时H2的物质的量逐渐增大,平衡逆向移动,a曲线代表反应物CO2,b、c代表生成物,b曲线代表的生成物的物质的量变化大,b曲线代表的物质是H2O,c曲线代表的生成物的物质的量变化小,则c代表的物质是C2H4。③利用三行式分析。设起始加入CO2的物质的量为x,则H2的物质的量为3x。
C2H4(g)+4H2O(g)正向为气体物质的量减小的反应,△S<0,由图2知随着温度的升高,平衡时H2的物质的量逐渐增大,平衡逆向移动,则该反应为放热反应,△H <0,根据△H-T△H<0判断该反应在低温自发进行。 ②分析图2知随着温度的升高,平衡时H2的物质的量逐渐增大,平衡逆向移动,a曲线代表反应物CO2,b、c代表生成物,b曲线代表的生成物的物质的量变化大,b曲线代表的物质是H2O,c曲线代表的生成物的物质的量变化小,则c代表的物质是C2H4。③利用三行式分析。设起始加入CO2的物质的量为x,则H2的物质的量为3x。
2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
起始(mol)x 3x 0 0
转化(mol)2 6 1 4
平衡(mol)2 6 1 4
解得x=4,3x=12。则T1温度下的反应物的平衡转化率为2/4×100%=50%;对于起始状态,气体的平均相对分子质量为(4×44+12×2)÷16=12.5,平衡时气体的平均相对分子质量为(4×44+12×2)÷13=15.4,增大的百分率为(15.4-12.5)/12.5×100%=23.1%。

【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
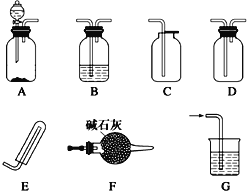
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为___________(填字母序号)。
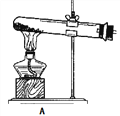

![]()

(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B的离子方程式_____________________________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”?____________(选填“能”或“不能”);简述你的理由:__________________________________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____________(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.00mL。
①所用指示剂为_______________;滴定终点时的现象为_________________________;
②H2C2O4溶液物质的量浓度为_______________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A. 滴定管在盛装NaOH溶液前未润洗
B. 滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C. 滴定前读数正确,滴定终点时俯视读数
D. 滴定前读数正确,滴定终点时仰视读数