题目内容
16.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙.下列有关物质的推断不正确的是( )| A. | 若甲为NH3,则丁可能是O2 | B. | 若甲为AlCl3,则丁可能是NaOH | ||
| C. | 若甲为NaOH溶液,则丁可能是CO2 | D. | 若甲为SiO2,则丁可能是C |
分析 A.甲为NH3,则丁可能是氧气,则乙为NO,丙为NO2;
B.若甲为AlCl3,丁可能是NaOH,则乙为氢氧化铝,丙为偏铝酸钠;
C.甲为NaOH溶液,则丁可能是CO2,乙为Na2CO3,丙为NaHCO3;
D.若甲为SiO2,如果丁可能是C,则乙为CO,CO与C不反应;
解答 解:A.甲为NH3,则丁可能是氧气,则乙为NO,丙为NO2,则NH3$\stackrel{O_{2}}{→}$NO$?_{NH_{3}}^{O_{2}}$NO2,符合转化关系,故A正确;
B.若甲为AlCl3,丁可能是NaOH,则乙为氢氧化铝,丙为偏铝酸钠,偏铝酸钠与氯化铝双水解得氢氧化铝,符合转化关系,故B正确;
C.甲为NaOH溶液,则丁可能是CO2,乙为Na2CO3,丙为NaHCO3,碳酸氢钠与氢氧化钠反应得到碳酸钠,符合转化关系,故C正确;
D.若甲为SiO2,如果丁可能是C,则乙为CO,CO与C不反应,不符合转化关系,故D错误,
故选D.
点评 本题考查无机物的推断,综合考查元素化合物性质,关键是掌握物质之间的相互转化,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.元素周期律(表)是认识元素化合物性质的重要理论.
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈.
ⅱ.锂和镁的氢氧化物均为中等强度的碱.
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物.
由以上事实,可知锂、钠、镁三种元素的金属性强弱关系是Na>Mg=Li.
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族.
①碱性:Sr(OH)2< Ba (OH)2(填“>”或“<”).
②用原子结构的观点解释锶的化学性质与钡差异的原因:锶和钡位于同一主族,锶的电子层数比钡少,原子半径小,失电子能力弱,金属性弱.
(3)硒(Se)的部分信息如右图,且知34Se、35Br位于同一周期.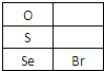
①Se在元素周期表中的位置是第四周期第VIA族.
②H2Se的电子式是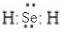 .
.
③Cl、Se、Br的非金属性强弱的顺序是Cl>Br>Se.
能证明上述非金属性强弱关系的事实是氢化物的稳定性(写出一条即可).
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的.
完成下表:
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈.
ⅱ.锂和镁的氢氧化物均为中等强度的碱.
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物.
由以上事实,可知锂、钠、镁三种元素的金属性强弱关系是Na>Mg=Li.
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族.
①碱性:Sr(OH)2< Ba (OH)2(填“>”或“<”).
②用原子结构的观点解释锶的化学性质与钡差异的原因:锶和钡位于同一主族,锶的电子层数比钡少,原子半径小,失电子能力弱,金属性弱.
(3)硒(Se)的部分信息如右图,且知34Se、35Br位于同一周期.

①Se在元素周期表中的位置是第四周期第VIA族.
②H2Se的电子式是
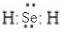 .
.③Cl、Se、Br的非金属性强弱的顺序是Cl>Br>Se.
能证明上述非金属性强弱关系的事实是氢化物的稳定性(写出一条即可).
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的.
完成下表:
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | SeO2+2SO2+2H2O═Se+2H2SO4 |
| 2 | 还原性 | SeO2+2H2O2=H2SeO4+2H2O |
| 3 | 酸性氧化物 | SeO2+NaOH=Na2SeO3+H2O |
7.在进行牙科治疗之前,吸入笑气(N2O)能明显减轻牙科焦虑症.同温同压下,相同质量的下列气体与笑气体积相等的是( )
| A. | N2 | B. | CO | C. | CO2 | D. | NO2 |
4.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | 石油裂解可获得乙烯,可从煤干馏得到的煤焦油中提取苯 | |
| B. | 衣服中的棉、麻成分都属于纤维素 | |
| C. | 用纯碱制玻璃,用铁矿石炼铁都会产生温室气体CO2 | |
| D. | 地沟油和矿物油的主要化学成分相同 |
11.一定浓度的盐酸和氨水混合后形成的混合溶液中,下列说法正确的是( )
| A. | 当溶液中c(Cl-)>c(NH4+)时,Mg2+、Na+、SO32-、NO3-可以大量共存 | |
| B. | 当溶液中c(Cl-)=c(NH4+)时,Na+、CH3CH2OH、[Ag(NH3)2]+可以大量共存 | |
| C. | 当溶液中c(Cl-)<c(NH4+)时,可以发生ClO-+Cl-+2H+═Cl2+H2O | |
| D. | 若溶液中c(Cl-)=c(NH4+)时,则盐酸和氨水按物质的量1:1混合 |
1.下列有关晶体的说法正确的是( )
| A. | 分子晶体中分子间一定存在范德华力 | |
| B. | 晶格能越大,离子晶体的能量越高 | |
| C. | 离子键、共价键、金属键、氢键都是化学键 | |
| D. | 原子间通过共价键形成的晶体一定具有高熔点和高硬度. |
8.下列各组物质属于同系物的是( )
| A. | H2和D2 | B. | 苯和甲苯 | C. | 正丁烷和异丁烷 | D. | 葡萄糖和果糖 |