题目内容
5.汽车排气中的CO、NOx已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOx、碳氢化合物转化为五毒物质,从而减少汽车尾气污染.已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
写出NO与CO催化转化成N2和CO2的热化学方程式2NO(g)+2CO(g)=N2(g)2CO2(g)△H=-746.5kJ/mol.
分析 已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
③C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
根据盖斯定律,③×2-②-①可得:2NO(g)+2CO(g)=N2(g)2CO2(g),反应热也进行相应计算.
解答 解:已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
③C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
根据盖斯定律,③×2-②-①可得:2NO(g)+2CO(g)=N2(g)2CO2(g),故△H=2×(-393.5kJ/mol)-(-221.0kJ/mol)-180.5kJ/mol=-746.5kJ/mol,
反应热化学方程式为:2NO(g)+2CO(g)=N2(g)2CO2(g)△H=-746.5kJ/mol,
故答案为:2NO(g)+2CO(g)=N2(g)2CO2(g)△H=-746.5kJ/mol.
点评 本题考查热化学方程式书写,注意根据盖斯定律构造目标热化学方程式,难度不大.

练习册系列答案
相关题目
15.下列关于化石燃料的说法正确的是( )
| A. | 石油分馏可获得石油气、汽油、苯及其同系物等 | |
| B. | 石油催化裂化主要得到乙烯、乙炔等 | |
| C. | 煤含有苯和甲苯,可干馏后获得苯和甲苯 | |
| D. | 煤的液化、气化属于均属于化学变化 |
16.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙.下列有关物质的推断不正确的是( )
| A. | 若甲为NH3,则丁可能是O2 | B. | 若甲为AlCl3,则丁可能是NaOH | ||
| C. | 若甲为NaOH溶液,则丁可能是CO2 | D. | 若甲为SiO2,则丁可能是C |
13.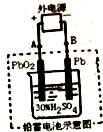 铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )
铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )
 铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )
铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )| A. | 放电时,电解质溶液中H2SO4的浓度将变大 | |
| B. | 放电时,正极反应式为:Pb+SO42--2e-=PbSO4 | |
| C. | 放电后用如图所示装置充电,电解质溶液中H+移向左边(PbO2极) | |
| D. | 用如图所示装置充电,阳极反应式为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
20.下列说法正确的是( )
| A. | 所有物质中都存在化学键 | |
| B. | 离子键在形成过程中一定伴随电子的得失 | |
| C. | 共价化合物中一定含有极性键 | |
| D. | 非极性键只存在于单质分子中 |
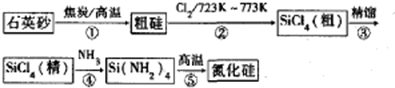
 .
.