题目内容
【题目】2011年12月30日中国环境保护部通过了新修订的《环境空气质量标准》,调整了污染物项目及限值,增设了PM2.5平均浓度限值,收紧了NO2等污染物的浓度限值。
(1)①甲烷是一种清洁燃料,在一定条件下,发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。

(2)某工厂利用尾气CO制甲醇,在一定压强和固定容积的容器中,通入a molCO与2a mol H2,在催化剂作用下反应:CO(g)+2H2(g) ![]() CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
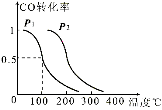
①P1 P2(填“<”、“>”或“=”)。
②下列各项中,不能说明该反应已达到平衡的是 。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
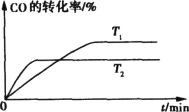
③如下图是该反应在不同温度下CO的转化率随时间变化的曲线。请分别画出在T1 、T2温度下,H2的浓度随时间变化的曲线
(3)某硝酸处理NO2方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)![]() =-483.6kJ/mol
=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)![]() =+67.7kJ/mol
=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
【答案】
(1)①3.0×10-3mol·L-1·min-1;
②b;负;CH4-8e-+2H2O=CO2↑+8H+;
(2)①<;②d ;③
(3)4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=-1034.9 kJ/mol
【解析】
试题分析:(1)①10min末有0.1mol CO生成,根据方程式CH4(g)+H2O(g) ![]() CO(g)+3H2(g)可知,生成的氢气为0.1mol×3=0.3mol,容器的体积为10L,则1min内用氢气表示的平均速率v(H2)=
CO(g)+3H2(g)可知,生成的氢气为0.1mol×3=0.3mol,容器的体积为10L,则1min内用氢气表示的平均速率v(H2)=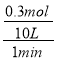 =3.0×10-3molL-1min-1;故答案为:3.0×10-3molL-1min-1;
=3.0×10-3molL-1min-1;故答案为:3.0×10-3molL-1min-1;
②根据装置可以知道d处生成大量的水,氢离子移向的电极为原电池的正极,所以c电极是通入的氧气,b口通入的物质为甲烷,电极Ⅰ是负极,甲烷在负极发生氧化反应,电极方程式为CH4-8e-+2H2O= CO2↑+8H+,故答案为:b;负;CH4-8e-+2H2O= CO2↑+8H+;
(2)①由图可知温度相同时,到达平衡时,压强为p2的CO转化率高,平衡向正反应方向移动,反应为气体体积减小的反应,增大压强平衡向体积减小的方向移动,即p1<p2;故答案为:<;
②a.该反应属于气体的物质的量发生变化的反应,恒温、恒容条件下,容器内的压强不发生变化,说明容器中气体的物质的量不变,能够说明该反应已达到平衡,不选;b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,表示正反应速率等于逆反应速率,能够说明该反应已达到平衡,不选;c.一定条件下,CO、H2和CH3OH的浓度保持不变,能够说明该反应已达到平衡,不选;d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH,均表示正反应速率,不能说明该反应已达到平衡,选;故选d;
③根据图像,温度T1>T2,升高温度,CO的转化率增大,平衡正向移动,H2的浓度减小,在T1 、T2温度下,H2的浓度随时间变化的曲线为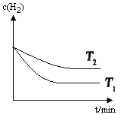 ,故答案为:
,故答案为: ;
;
(3)2H2(g)+O2(g)=2H2O(g)△H=-483.6kJmoL-1 (1),N2(g)+2O2(g)=2NO2(g)△H=+67.7kJmoL-1(2),将方程式(1)×2-(2)得4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=2(-483.6kJmoL-1)-(+67.7kJmoL-1)=-1034.9 kJmoL-1,故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9 kJmoL-1。

 优加精卷系列答案
优加精卷系列答案【题目】某些化学知识用数轴表示能体现出形象直观、简明易记的特点。下列用数轴表示不合理的是
A.Cl2与CCl4取代反应后的产物 |
|
B.向烧碱液中通入SO2后的产物 |
|
C.铁和稀硝酸反应 |
|
D.向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式 |
|