题目内容
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+5HCl,发生的副反应为:C2H5OH+HCl→C2H5Cl+H2O。某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持加热装置均略去)。回答下列问题:

(1)装置A中发生反应的离子方程式为___________。
(2)仪器a的名称是___________,其作用是___________。
(3)若撤去装置B,对实验的影响是___________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是___________。
(5)测定产品的纯度:
①称取0.40g产品,配成待测溶液加入20.00mL0.100mol/L碘标准溶液,再加入适量碱液,充分反应:CC13CHO+OH-→CHCl3+HCOO-,HCOO-+I2=H++2I-+CO2↑;
②再加适量盐酸调节溶液的pH,并立即用0.020mo/L的Na2S2O3溶液滴定至终点,发生反应:I2+2S2O32-=2I-+S4O62-;
③重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。滴定时所用指示剂是___________,达到滴定终点的现象是_____,测得产品的纯度为____。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 球形冷凝管 冷凝回流,减少原料损失 会有氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低 停止对A加热或控制滴加盐酸的量 淀粉 当观察到溶液蓝色变为无色,且半分钟内不变色,应为滴定终点 66.4%
Mn2++Cl2↑+2H2O 球形冷凝管 冷凝回流,减少原料损失 会有氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低 停止对A加热或控制滴加盐酸的量 淀粉 当观察到溶液蓝色变为无色,且半分钟内不变色,应为滴定终点 66.4%
【解析】
A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl, C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,防止污染空气。
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;
(2)根据仪器a的结构确定a的名称及作用;
(3)撤去B装置,增大副反应C2H5OH+ HCl→C2H5Cl+ H2O的发生;
(4) 实验时发现D中导管口处气泡速率过快,可能导致反应不充分,需要控制氯气的生成速率;
(5)碘遇淀粉溶液变蓝色,滴加Na2S2O3溶液会导致碘被还原,溶液的颜色会变浅,最终消失,根据消耗的Na2S2O3计算剩余I2的物质的量,进而计算与HCOO-反应的I2的物质的量,再根据关系式: CCl3CHO~~HCOO-~~I2计算。
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,装置A中发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)根据仪器的构造可知,仪器a为球形冷凝管;其作用是冷凝回流,减少原料损失;
(3)B装置用饱和食盐水除去HCl,减少副反应发生,若撤去B装置,因氯气中混有HCl,增大副反应C2H5OH+ HCl→C2H5Cl+ H2O的发生,导致装置D中副产物C2H5Cl增多,故答案为:会有氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低;
(4)实验时发现D中导管口处气泡速率过快,可通过停止对A加热或控制滴加盐酸的量来调整,故答案为:停止对A加热或控制滴加盐酸的量;
(5)根据碘遇淀粉溶液变蓝色,可选择淀粉作指示剂,在滴加Na2S2O3溶液时,当观察到溶液蓝色变为无色,且半分钟内不变色,应为滴定终点;
根据消耗的Na2S2O3计算,剩余I2的物质的量0.02000mol/ L×0.02L×![]() =2×10-4mol,与HCOO-反应的I2的物质的量为0.1000mol/ L×0.02L-2×10-4mol = 1.8×10-3mol,
=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000mol/ L×0.02L-2×10-4mol = 1.8×10-3mol,
由CCl3CHO~ HCOO- ~ I2可知:
CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为:
![]() = 66.4%。
= 66.4%。

【题目】按如图装置进行实验,下列推断正确的是( )
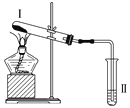
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D