题目内容
(12分)下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题。
(1)②表示的元素是 (填元素符号);
(2)①、⑤两种元素的原子半径大小为:① ⑤(填“<”或“>”);
(3)③、④两种元素的金属性强弱顺序为:③ ④(填“<”或“>”);
(4)写出③与⑥两种元素所形成化合物的化学式__________。
| 族 周期 | ⅠA | | | | 0 | ||||
| 1 | H | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | | |
| 2 | | | | | | ① | ② | F | Ne |
| 3 | ③ | Mg | | ④ | Si | ⑤ | | ⑥ | |
(2)①、⑤两种元素的原子半径大小为:① ⑤(填“<”或“>”);
(3)③、④两种元素的金属性强弱顺序为:③ ④(填“<”或“>”);
(4)写出③与⑥两种元素所形成化合物的化学式__________。
(1)O (2)< (3)> (4)NaCl
(1)根据在元素周期表中的位置,②表示的元素是O;
(2)同主族元素半径,从上往下逐渐增大;①、⑤两种元素的原子半径大小为:①<⑤;
(3)同周期元素的金属性逐渐减弱,非金属性逐渐增强;③、④两种元素的金属性强弱顺序为:③>④;
(4)③与⑥两种元素所形成化合物的化学式NaCl。
点评:考查元素周期表的位-构-性问题。
(2)同主族元素半径,从上往下逐渐增大;①、⑤两种元素的原子半径大小为:①<⑤;
(3)同周期元素的金属性逐渐减弱,非金属性逐渐增强;③、④两种元素的金属性强弱顺序为:③>④;
(4)③与⑥两种元素所形成化合物的化学式NaCl。
点评:考查元素周期表的位-构-性问题。

练习册系列答案
相关题目
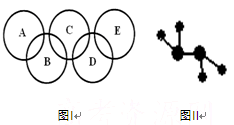
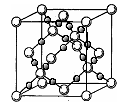
 A是沼气的主要成分;B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型如图Ⅱ;C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
A是沼气的主要成分;B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型如图Ⅱ;C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
 Cn
Cn Cn互为同位素,二者中子数之差为8
Cn互为同位素,二者中子数之差为8