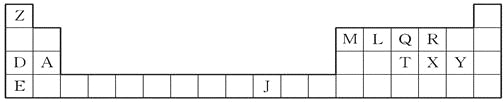
题目内容
【题目】在一些茶叶的包装盒中有一个小袋,将小袋打开可看到灰黑色粉末,其中有的已变成棕褐色。将这种灰黑色粉末投入稀盐酸后,取其上层清液并加几滴氯水,再滴加KSCN溶液,马上出现红色。以下结论不正确的是 ( )
A.该灰黑色粉末作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
【答案】D
【解析】
试题分析:铁粉为黑色粉末,他在空气中吸收了氧气后,被氧化为氧化铁(红色),颜色变为灰黑色粉末并伴有棕褐色,加入盐酸后,Fe2O3+6HCl=2FeCl3+3H2O, Fe3+与SCN-反应生成血红色溶液,利用上述过程防止茶叶被氧气氧化,起到抗氧化作用;答案D错误;

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
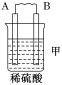
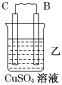
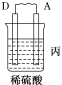
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________________。
(2)装置乙,若电路中转移6.02×1022个e﹣,则C上增加的质量为 。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________________。