题目内容
【题目】(1)写出CH4和Cl2在光照的条件下生成CH3Cl的化学反应方程式_________
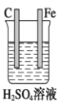
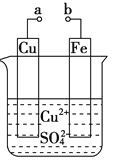
(2)写出如图所示原电池的电极方程式:
负极:_______________________
正极:_______________________
【答案】CH4+Cl2![]() CH3Cl+HCl Zn-2e-=Zn2+ 2H++2e-= H2↑
CH3Cl+HCl Zn-2e-=Zn2+ 2H++2e-= H2↑
【解析】
(1)发生取代反应反应生成一氯甲烷和HCl;
(2)根据原电池工作原理写出负极、正极的电极反应。
(1)甲烷与氯气在光照的条件下发生取代反应,第一步是1个氯原子替换出1个氢原子,另一个氯原子则与氢原子结合生成氯化氢,反应方程式为CH4+Cl2![]() CH3Cl+HCl,
CH3Cl+HCl,
故答案为:CH4+Cl2![]() CH3Cl+HCl;
CH3Cl+HCl;
(2)反应Zn+2H+═Zn2++H2↑中,锌在负极失去电子生成锌离子,电极反应为:Zn-2e-═Zn2+;氢离子在正极得到电子生成氢气,发生得到电极反应为:2H++2e-= H2↑,
故答案为:Zn-2e-=Zn2+;2H++2e-= H2↑。

 优学名师名题系列答案
优学名师名题系列答案【题目】八种短周期元素x、y、z、d、e、f、g、h原子序数依次递增,其原子半径、最高正价或最低负价如下表所示。
x | y | z | d | e | f | g | h | |
原子半径/nm | 0.037 | 0.077 | 0.075 | 0.074 | 0.186 | 0.143 | 0.102 | 0.099 |
最高正化合价或最低负化合价 | +1 | +4 | +5 | -2 | +1 | +3 | -2 | -1 |
回答下列问题:
(1)比较d、f常见离子的半径大小(用化学式表示,下同):_______>________;比较g、h的最高价氧化物对应水化物的酸性强弱:________>__________。
(2)由x、d两种元素组成18电子的分子,其电子式为____________,经测定其为二元弱酸,其酸性比碳酸弱,写出其第一步电离的电离方程式____________。
(3)y、d、e组成物质e2yd3的水溶液呈碱性,其原因是____________________(用离子方程式表示),电解该物质e2yd3的溶液,原理如图所示。

其中,离子交换膜使用的是__________(填“阳离子交换膜”或“阴离子交换膜”),阴极产生的物质A的化学式为____________。
(4)f的粉末在1000℃时可与N2反应制备fN。在f的粉末中添加少量NH4Cl固体并充分混合,有利于fN的制备,其主要原因是____________________________________。