题目内容
【题目】十九大报告中指出“持续实施大气污染防治行动,打赢蓝天保卫战”。SO2为大气污染物,研究它的性质对治理具有重要意义。在铝基氧化铜作催化剂时,可利用天然气脱除二氧化硫,并回收单质硫(熔点为112.8℃,沸点为444.6℃)。
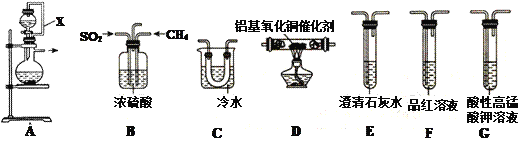
(1)①装置中导管X的作用是:______________________________。
②用装置A制取SO2,则试剂的组合最好是_________(填字母)。
a. 18.4 mol/L H2SO4+Cu b. 4 mol/L HNO3+Na2SO3 c. 60% H2SO4+K2SO3
③水与Al4C3在装置A中制取甲烷,其化学方程式为:________________。
(2)利用制得的CH4和SO2并结合B~G装置验证反应:CH4+2SO2 .![]() 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。
①B装置有三个作用,分别是________________________、充分混合CH4和SO2、观察气泡以便调节CH4和SO2的流速比约为1∶2。
②实验装置依次连接的合理顺序为B、_____________________(每个装置只用一次)。
③证明有CO2产生的现象为_____________________________。
④G装置中发生反应的离子方程式为_____________________________。
【答案】使液体顺利滴入烧瓶中 c Al4C3+12H2O==4Al(OH)3↓+3CH4↑ 干燥CH4、SO2 D、C、G、F、E F中品红不褪色,澄清石灰水变浑浊 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
【解析】
(1)①由于装置A的蒸馏烧瓶中产生气体,使其中的压强增大,在分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是平衡压强,使液体顺利滴入烧瓶中。②a项,装置A为固液不加热装置,“18.4mol/LH2SO4+Cu”制取SO2需要加热,故不适合;b项,“4 mol/LHNO3+Na2SO3”发生氧化还原反应,+4价S被氧化成+6价,得不到SO2,故不适合;c项,“60%H2SO4+K2SO3”制取SO2适合强酸制弱酸原理,故合适。③水与Al4C3制取甲烷,根据原子守恒还生成Al(OH)3,故化学方程式为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑。
(2)①如图CH4和SO2的反应需要高温条件下在硬质玻璃管中进行,所以B中浓硫酸除了充分混合CH4和SO2、观察气泡以便调节CH4和SO2的流速比约为1∶2之外,还有干燥CH4和SO2的作用。②根据实验目的是验证CH4和SO2反应生成的单质S和CO2,装置C冷却得到固体S单质,用E装置中澄清石灰水验证CO2,为防止SO2对验证实验的干扰,必须先依次通过酸性高锰酸钾和品红溶液,将其除尽,综上分析实验装置依次连接的合理顺序为B、D、C、G、F、E。③若F中品红不褪色,则说明SO2已经被除尽,E中澄清石灰水变浑浊则能证明该实验有CO2产生。④G装置中,酸性高锰酸钾与SO2发生氧化还原反应,+7价Mn被还原为+2价,+4价S被氧化为+6价,离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
