题目内容
17.同温同压下,若CH4和NH3的体积相同,则质量比为16:17;在标准状况下,1.7g NH3与标准状况下3.36L H2S含有相同数目的氢原子.分析 同温同压下,气体摩尔体积相等,相同体积的不同气体其物质的量相等,根据m=nM计算其质量之比;氨气和硫化氢分子中H原子个数之比为3:2,要使氨气和硫化氢的氢原子个数相等,则氨气和硫化氢的物质的量之比为2:3,根据V=nVm计算硫化氢体积.
解答 解:同温同压下,气体摩尔体积相等,相同体积的不同气体其物质的量相等,根据m=nM知其质量之比等于摩尔质量之比=16g/mol:17g/mol=16:17;氨气和硫化氢分子中H原子个数之比为3:2,要使氨气和硫化氢的氢原子个数相等,则氨气和硫化氢的物质的量之比为2:3,硫化氢体积V=nVm=$\frac{3}{2}$×$\frac{1.7g}{17g/mol}$×22.4L/mol=3.36L,
故答案为:16:17;3.36.
点评 本题考查物质的量有关计算,为高频考点,明确物质的量公式中各个物理量的关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
7.3717Cl-中含有的电子数是( )
| A. | 17 | B. | 18 | C. | 20 | D. | 37 |
8.在一密闭容器中,反应 aA(气)?bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的40%,则( )
| A. | 平衡常数减小 | B. | 物质A的转化率增加了 | ||
| C. | 平衡向正反应方向移动了 | D. | a>b |
5.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 铅蓄电池放电的正极电极反应式:PbO2+4H++2e-═Pb2++2H2O | |
| B. | 氢氧碱性燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
12.下列说法正确的是( )
| A. | 在测定溶液的pH时,先用蒸馏水湿润,后用玻璃棒醮取溶液点在试纸中部,再与标准比色卡比较 | |
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- | |
| C. | 提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法为加入过量的K2CO3溶液,过滤除去沉淀,所得溶液中补加适量HNO3 | |
| D. | 实验过程中用不完的钠和白磷应直接扔到废液缸中 |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molFe与1molCl2充分反应,转移的电子数为3NA | |
| B. | NA个Fe(OH)3胶体粒子形成的纳米材料的质量为107g | |
| C. | 含有4.6g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA | |
| D. | 标准状况下,22.4 LSO3含有NA个分子 |
9.下列离子方程式中书写正确的是( )
| A. | 硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
7.下列有关化学用语表达正确的是( )
| A. | H2O2的电子式: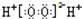 | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 乙酸分子的球棍模型: | |
| D. | 离子结构示意图 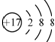 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |