题目内容
【题目】石油是工业的血液,通过它可以得到很多重要的化工产品。

已知: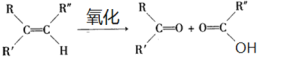
(1)B和A为同系物,B的结构简式为_________________;
(2)反应①的化学方程式为__________________,其反应类型为___________;
(3)写出检验C3H5Cl中含有Cl原子的方法:______________;
(4)C的结构简式为______________;
(5)反应④的化学方程式为_______________;
(6)设计一条由乙烯为原料制备D的合成路线(其他无机原料任选)____________。(合成路线格式如下:CH3CH2OH ![]() H2C=CH2
H2C=CH2 ![]() BrCH2CH2Br)
BrCH2CH2Br)
【答案】CH2=CHCH3 CH2=CH2+H2O![]() CH3CH2OH 加成反应 加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl原子 HOOC—COOH CH2=CHCH2Cl+NaOH
CH3CH2OH 加成反应 加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl原子 HOOC—COOH CH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl
CH2=CHCH2OH+NaCl 
【解析】
C2H6O与C反应生成D,由D的结构简式可知C为HOOC-COOH,C2H6O为CH3CH2OH,则A为CH2=CH2,与水发生加成反应生成乙醇;C3H5Cl发生卤代烃的水解反应生成CH2=CHCH2OH,则C3H5Cl为CH2=CHCH2Cl,B为CH2=CHCH3,据此分析解答。
(1)由于B与氯气反应产物为C3H5Cl,该反应为取代反应,故B分子式为C3H6,B和A为同系物,可知B中含有一个不饱和键,根据分子式可推知B为CH2=CHCH3,故答案为:CH2=CHCH3;
(2)由以上分析可知,A为CH2=CH2,反应①的化学方程式为CH2=CH2+H2O![]() CH3CH2OH,为加成反应,故答案为:CH2=CH2+H2O
CH3CH2OH,为加成反应,故答案为:CH2=CH2+H2O![]() CH3CH2OH;加成反应;
CH3CH2OH;加成反应;
(3)检验C3H5Cl中含有Cl原子的方法为:加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl原子;故答案为:加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl原子;
(4)根据以上分析可知,C为HOOC-COOH,故答案为:HOOC-COOH;
(5)反应④为卤代烃的水解反应,反应的化学方程式为CH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl,故答案为:CH2=CHCH2Cl+NaOH
CH2=CHCH2OH+NaCl,故答案为:CH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl;
CH2=CHCH2OH+NaCl;
(6)D为乙二酸二乙酯,则由乙二酸和乙醇发生酯化反应制得,乙烯与水发生加成反应可生成乙醇,乙烯与溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷在氢氧化钠的水溶液中水解生成乙二醇,乙二醇氧化可以生成乙二酸,所以由乙烯为原料制备D的合成路线为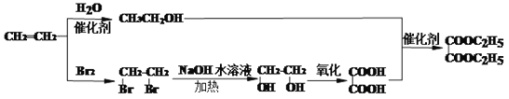 ,故答案为:
,故答案为: 。
。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | a | b | c |
工业上合成氨的反应 N2(g)+3H2(g) 2NH3(g) ΔH=_____kJ·mol-1.
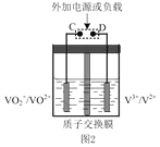
(2)肼—空气燃料电池是一种环保型燃料电池,结构如图 1 所示
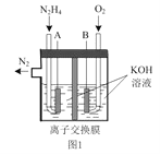
①肼—空气燃料电池的负极反应式为_____
②全钒液流可充电电池结构如图 2 所示,将肼—空气燃料电池的 A 极与全钒液流可充电电池的 C 极相连,B 极与 D 极相连,写出阴极的电极反应____
(3)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,与使用 Na2SO3 处理水中溶解的 O2 相比,肼的优点是_____
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D