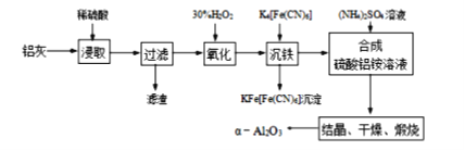
题目内容
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下离子中的若干种:NH4+、Ba2+、Fe2+、Cl-、NO3-、CO32- 、SO42-.某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成如下实验:

试回答下列问题:
(1)实验①中加入稀盐酸后,有无色气体A生成,溶液B依然澄清,且溶液中阴离子种类不变,据此可知原溶液中一定不含__________。(填离子符号)
(2)实验①中发生反应的离子方程式为__________________________________________。
(3)实验②中逐滴加入碳酸氢钠溶液,立即有气泡产生,一段时间后又有沉淀出现,这时的离子方程式为_______________________________________________ 。
(4)气体F的成分为______________。(填化学式)
(5)根据实验③现象该同学认为原溶液中一定含有SO42-,有其他同学认为其结论不合理,又进行了后续实验 ④,最终确认原溶液中含有SO42-,试写出实验④可行的操作方法及现象________________。
【答案】CO32-3Fe2++NO3-+4H+=3Fe3++NO↑+2H2OFe3++3HCO3-=Fe(OH)3↓+3CO2↑NH3向沉淀G中加入足量的稀硝酸,若沉淀部分溶解,则证明原溶液中含有SO42-
【解析】
(1)实验①中加入稀盐酸后,有气体A生成,该气体可能为CO2或NO,由于稀盐酸足量且反应后溶液中阴离子种类不变,则原溶液中一定不含有CO32-,一定含有Cl-,气体A为NO,故原溶液中一定含有Cl-、Fe2+、NO3-,一定不含有CO32-。
(2)实验①加入足量稀盐酸,二价铁离子和硝酸根发生氧化还原反应,生成一氧化氮,离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
(3)实验①加入足量稀盐酸,溶液B中含有过量的H+,则加入NaHCO3溶液后发生反应的离子方程式为H++HCO3-=CO2↑+H2O。溶液B中还含有Fe3+,H+反应完后,Fe3+与HCO3-发生相互促进的水解反应,离子方程式为Fe3++3 HCO3-=3CO2↑+Fe(OH)3↓。
(4)溶液D中加入足量Ba(OH)2溶液加热后生成气体F、沉淀G和溶液H,气体F为NH3。
(5)由于实验②中NaHCO3过量,故沉淀G中一定含有BaCO3,不能确定沉淀G中是否含有BaSO4,需要进行后续实验④,即向沉淀G中加入足量的稀盐酸,若沉淀部分溶解,则证明原溶液中含有SO42-。

 名校课堂系列答案
名校课堂系列答案【题目】已知下列原子的半径:
原子 | N | S | O | Si |
半径r/10-10 m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,P原子的半径可能是( )
A.1.10×10-10 mB.1.08×10-10 m
C.1.20×10-10 mD.0.70×10-10 m