题目内容
【题目】肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | a | b | c |
工业上合成氨的反应 N2(g)+3H2(g) 2NH3(g) ΔH=_____kJ·mol-1.
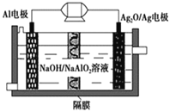
(2)肼—空气燃料电池是一种环保型燃料电池,结构如图 1 所示
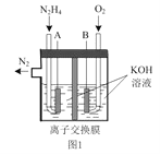
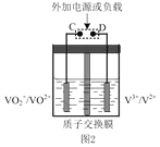
①肼—空气燃料电池的负极反应式为_____
②全钒液流可充电电池结构如图 2 所示,将肼—空气燃料电池的 A 极与全钒液流可充电电池的 C 极相连,B 极与 D 极相连,写出阴极的电极反应____
(3)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,与使用 Na2SO3 处理水中溶解的 O2 相比,肼的优点是_____
【答案】b+3a-6c N2H4+4OH--4e- = N2↑+4H2O VO2++2H++e-=VO2++H2O 用肼处理,不会产生硫酸钠电解质,避免对锅炉造成腐蚀
【解析】
(1)利用反应物的总键能与生成物的总键能之差,可求出工业上合成氨反应N2(g)+3H2(g) 2NH3(g)的ΔH。
(2)①从图中可以看出,肼—空气燃料电池中,A为负极,B为正极,负极N2H4失电子的产物与OH-反应生成H2O和N2,由此可写出电极反应式。
② 肼—空气燃料电池的 A 极(负极)与全钒液流可充电电池的 C 极相连,则C极为阴极,B 极(正极)与 D 极(阳极)相连,则阴极(C极) VO2+得电子的产物与H+反应,生成H2O和VO2+,由此可写出电极反应式。
(3)肼处理水中的氧,生成N2和水,而Na2SO3 处理水中溶解的 O2,生成Na2SO4电解质,易使锅炉发生吸氧腐蚀。
(1) ΔH=反应物的总键能-生成物的总键能= [(b+3a)-6c] kJ·mol-1 =( b+3a-6c)kJ·mol-1。答案为:b+3a-6c;
(2)①由以上分析可知,肼—空气燃料电池中,A为负极,N2H4失电子的产物与OH-反应生成H2O和N2,电极反应式为N2H4+4OH--4e- = N2↑+4H2O。答案为:N2H4+4OH--4e- = N2↑+4H2O;
②肼—空气燃料电池中,阴极(C极) VO2+得电子的产物与H+反应,生成H2O和VO2+,电极反应式为VO2++2H++e- =VO2++H2O。答案为:VO2++2H++e- =VO2++H2O;
(3)肼处理水中的氧,生成N2和水,而Na2SO3处理水中溶解的O2,生成Na2SO4电解质,易使锅炉发生吸氧腐蚀,从而得出肼的优点是用肼处理,不会产生硫酸钠电解质,避免对锅炉造成腐蚀。答案为:用肼处理,不会产生硫酸钠电解质,避免对锅炉造成腐蚀。

【题目】汽车尾气中含有CO、NO、NO2等多种污染物。
(1)在汽车的排气管上装一个催化转换装置,能使CO和NO反应生成无污染的气体,写出该反应的化学方程式_____
(2)研究表明:增大催化剂(相同质量下比较)比表面积可提高化学反应速率,为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | CO 初始浓度/mol·L-1 | NO 初始浓度/mol·L-1 | 催化剂的比表面积/m·g-1 |
Ⅰ | 300 | 4.5×10-3 | 1.5×10-3 | 100 |
Ⅱ | ______ | 4.5×10-3 | 1.5×10-3 | 200 |
Ⅲ | 500 | 4.5×10-3 | _________ | 200 |
请在上表格中填入剩余的实验条件数据,三组实验中的反应速率由快到慢的顺序为 ______(填实验编号)
(3)大众"检测门"事件让"尿素可用于汽车尾气脱氮”又科普了一把,其反应原理为:NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O
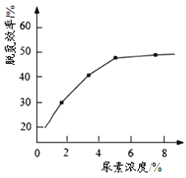
① 图为尿素含量对脱氮效率的影响,一般选择尿素浓度约5%左右,其原因是_______
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=3:1时,可通入一定量的空气,同温同压下,V(空气):V(NO2)=_____(空气中氧气的体积含量大约为 20%)