��Ŀ����
����Ŀ��80 ��ʱ��2 L �ܱ������г���0.40 mol N2O4��������ӦN2O4![]() 2NO2 ��H����Q kJ��mol-1��Q��0��������������ݣ�
2NO2 ��H����Q kJ��mol-1��Q��0��������������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol��L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
�����ж���ȷ������ ��
A. �����¶ȸ÷�Ӧ��ƽ�ⳣ��K��С
B. 20��40 s �ڣ�v��N2O4����0.004 mol��L-1��s1
C. ��Ӧ��ƽ��ʱ�����յ�����Ϊ0.30 Q kJ
D. 100 s ʱ��ͨ��0.40 mol N2O4������ƽ��ʱN2O4��ת��������
���𰸡�C
������������ A�÷�ӦΪ���ȷ�Ӧ,�¶�����,ƽ�������ȵķ����ƶ�����������Ӧ�����ƶ�,ƽ�ⳣ��K����,A����B�����ݱ������ݿ�֪20��40s �ڵķ�Ӧ����Ϊv(NO2)��![]() ����Ӧ����֮���ǻ�ѧ������֮�ȣ���v(N2O4)��0.5v(NO2)��0��002mol/(L��s)��B����C��Ũ�Ȳ���ʱ��˵����Ӧ�Ѵ�ƽ�⣬��Ӧ��ƽ��ʱ������NO2�����ʵ���Ϊ0��30molL-1��2L��0��60mol�����Ȼ�ѧ����ʽ��֪����2molNO2��������QkJ����������0��6molNO2��������0��3QkJ��C��ȷ��D��100sʱ��ͨ��0��40mol N2O4��ƽ��״̬�൱������ѹǿ��ƽ�������ƶ���N2O4��ת���ʼ�С��D����ѡC��
����Ӧ����֮���ǻ�ѧ������֮�ȣ���v(N2O4)��0.5v(NO2)��0��002mol/(L��s)��B����C��Ũ�Ȳ���ʱ��˵����Ӧ�Ѵ�ƽ�⣬��Ӧ��ƽ��ʱ������NO2�����ʵ���Ϊ0��30molL-1��2L��0��60mol�����Ȼ�ѧ����ʽ��֪����2molNO2��������QkJ����������0��6molNO2��������0��3QkJ��C��ȷ��D��100sʱ��ͨ��0��40mol N2O4��ƽ��״̬�൱������ѹǿ��ƽ�������ƶ���N2O4��ת���ʼ�С��D����ѡC��

����Ŀ����ͼ��Ԫ�����ڱ���һ���֣���ش��������⣺
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0�� | |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� |
(1)����ЩԪ���У����ʵĻ�ѧ�������������___����Ԫ�ط��ţ���
(2)�۵���̬�⻯��ĵ���ʽ___���ڢ��γɵ���̬������Ľṹʽ___��
(3)��ЩԪ���γɵ�����������ˮ�����У�������ǿ�Ļ�����Ϊ___�������ʵĻ�ѧʽ����д�����ĵ���ʽ��___��������ǿ�ĺ�����Ϊ___�������ʵĻ�ѧʽ����д�����ĵ��뷽��ʽ��___��
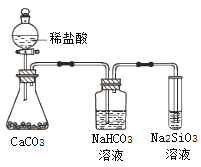
(4)�ڢں͢�����Ԫ���У��ǽ����Խ�ǿ����___����Ԫ�����ƣ����ڵĵ��ʿ��Ժ͢۵�����������ˮ���ﷴӦ����д���йػ�ѧ����ʽ___��
(5)����SiԪ�طֱ��γɵ���������___���۵���ߣ�ԭ����___��