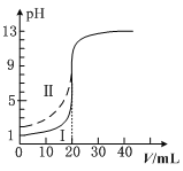
题目内容
【题目】已知常温下D为生活中常见的无色无味的液体,F为淡黄色粉末(反应条件均已省略),请根据下列要求回答有关问题:
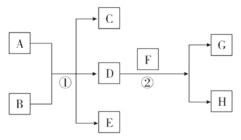
(1)写出②的化学方程式________________________ ,当生成5.6 L气体G(标准状况)时,此时反应转移的电子数目为(阿伏加德罗常数为NA)________。
(2)若A,C,E均含有氯元素,且A为单质,B为强碱溶液,写出该条件下反应①的离子方程式:__________________________________。
(3)若C,E均为气体且都能使澄清石灰水变浑浊,A为固体单质,写出该条件下反应①的化学方程式:_______________________________。
(4)若A与B均为固体化合物,E是能使湿润的红色石蕊试纸变蓝的气体,反应①常用于实验室制取气体E,写出该反应的化学方程式:_____________________。
【答案】2Na2O2+2H2O===4NaOH+O2↑ 0.5NA Cl2+2OH-===Cl-+ClO-+H2O C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 2NH4Cl+Ca(OH)2
CO2↑+2SO2↑+2H2O 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
D为生活中常见的无色无味的液体,F为淡黄色粉末,二者能够发生反应,可知D为水,F为过氧化钠,生成的气体G为氧气,根据物质之间的转化关系及物质的性质进行推断解答。
(1)由分析可知,D为水,F为过氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,故G为氧气,化学方程式为:2Na2O2+2H2O===4NaOH+O2↑,氧气是氧化产物,生成氧气的物质的量=![]() =0.25mol,转移电子数为0.25mol×2×[0-(-1)]=0.5mol=0.5NA,答案为:2Na2O2+2H2O===4NaOH+O2↑;0.5NA;
=0.25mol,转移电子数为0.25mol×2×[0-(-1)]=0.5mol=0.5NA,答案为:2Na2O2+2H2O===4NaOH+O2↑;0.5NA;
(2) 若A,C,E均含有氯元素,且A为单质,则A为氯气,B为强碱溶液,反应①为氯气与强碱的歧化反应,根据氯气与氢氧化钠的反应可写出反应①的离子方程式为:Cl2+2OH-===Cl-+ClO-+H2O,答案为:Cl2+2OH-===Cl-+ClO-+H2O;
(3) 若C,E均为气体且都能使澄清石灰水变浑浊,即C,E是二氧化碳和二氧化硫,D为水,A为固体单质,所以C、D、E是浓硫酸和碳单质反应的产物,化学方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,答案为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(4) 若A与B均为固体化合物,E是能使湿润的红色石蕊试纸变蓝的气体,则E为氨气,实验室通常用加热氯化铵和氢氧化钙的混合物来制取氨气,化学方程式为: 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

【题目】苯胺(![]() )是重要的化工原料。某兴趣小组在实验室里制取并纯化苯胺。
)是重要的化工原料。某兴趣小组在实验室里制取并纯化苯胺。
已知:①![]() 与NH3相似,与盐酸反应生成
与NH3相似,与盐酸反应生成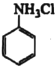 (易溶于水的盐)。
(易溶于水的盐)。
②用硝基苯制取苯胺的反应为:2![]() +3Sn+12HCl
+3Sn+12HCl![]() 2
2![]() +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/g·cm-3 |
苯胺 | 93 | 6.3 | 184 | 微溶于水,易溶于乙醚 | 1.02 |
硝基苯 | 123 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
乙醚 | 74 | 116.2 | 34.6 | 微溶于水 | 0.7134 |
Ⅰ.制备苯胺
图1所示装置中加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,向三颈烧瓶中滴入一定量50%NaOH溶液,至溶液呈碱性。
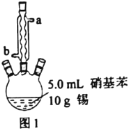
(1)滴加适量NaOH溶液的目的是___,写出主要反应的离子方程式___。
ⅰ.取出图l所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气。用“水蒸气蒸馏”的方法把B中苯胺逐渐吹出,在烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液甲。
ⅱ.向所得水溶液甲中加入氯化钠固体至饱和,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺1.86g。
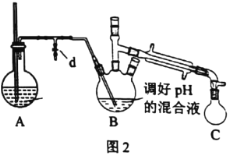
(2)装置A中玻璃管的作用是__。
(3)在苯胺吹出完毕后,应进行的操作是先__,再___。
(4)该实验中苯胺的产率为___(保留三位有效数字)。
(5)欲在不加热条件下除去苯胺中少量的硝基苯杂质,简述实验方案___。