题目内容
(15分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(ΔH)分别为-890.3kJ·mol-1、-285.8kJ.mol-1和-283.0kJ.mol-1,则生成1m3(标准状况)CO所需热量为 ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为
;
(4)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):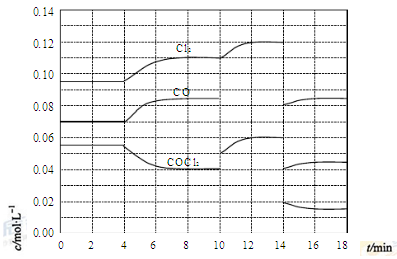
①计算反应在第8min时的平衡常数K= ;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)
(填“<”、“>”或“=”),
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率(平均反应速率分别以v(2-3)、v(5-6)、v(12-13))的大小 ;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6) v(15-16)(填“<”、“>”或“=”),原因是 。

解析

(12分)工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤。
(1)在接触室中2SO2(g)+O2(g)  2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。
| A.υ(O2)正=2υ(SO2)逆 |
| B.容器中气体的总质量不随时间而变化 |
| C.容器中气体的颜色不随时间而变化 |
| D.容器中气体的压强不随时间而变化 |
 2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。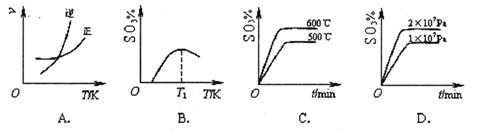
(3)某温度下SO2(g)+
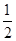 O2(g)
O2(g)  SO3(g) ΔH=-98KJ/mol
SO3(g) ΔH=-98KJ/mol①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______
②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________
(4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________
(14 分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1
反应CO2(g)+CH4(g)
 2CO(g)+2H2(g) 的△H= ;
2CO(g)+2H2(g) 的△H= ;③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是 ;
 (?代表CO的生成速率,■代表催化剂的催化效率)
(?代表CO的生成速率,■代表催化剂的催化效率)④为了提高该反应中CH4的转化率,可以采取的措施是 ;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向 (填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式: ;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。
氮的固定有三种途径:生物固氮、自然固氮和工业固氮。根据最新“人工固氮”的研究报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间1 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
 4NH3(g)+3O2(g)ΔH=a kJ·mol-1
4NH3(g)+3O2(g)ΔH=a kJ·mol-1回答下列问题:
(1)此合成反应的a________0;ΔS________0,(填“>”、“<”或“=”)
(2)已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92 .4 kJ·mol-1
2NH3(g) ΔH=-92 .4 kJ·mol-12H2(g)+O2(g) ===2H2O(l) ΔH =-571.6 kJ·mol-1
则2N2(g)+6H2O(l)===4NH3(g)+3O2 (g) ΔH=________kJ·mol-1
(3)从323 K到353 K,氨气的生成量减少的可能原因_________________;
(4)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答: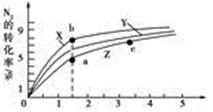
①在上述三种温度中,曲线X对应的温度是________。
②a、b、c三点H2的转化率最小的是________点、转化率最大的是________点。
③在容积为1.0 L的密闭容器中充入0.30 mol N2(g)和0.80 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。该条件下反应2NH3(g)
 N2(g)+3H2(g)的平衡常数为________ 。
N2(g)+3H2(g)的平衡常数为________ 。  时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)
时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。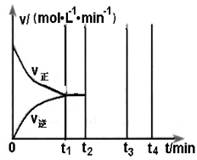
 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。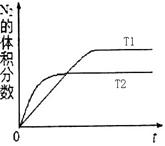
 E(g)
E(g)