题目内容
【题目】工业废气中的NO2、CO2对环境具有极大影响,利用化学反应原理对其处理,对构建“绿水青山”生态文明有重要意义。请回答下列问题:
(1)下列说法正确的是_________
A.CO2和NO2与水反应所得溶液均为弱酸
B.NO2在一定条件下能与NH3反应生成环境友好的物质
C.通过测定溶液的pH,一定能判断H2CO3和HNO2的酸性强弱
D.Na2CO3溶液中加入硫酸可生成CO2
(2)H2在催化剂存在下能与NO2反应生成水蒸气和氮气而消去工业尾气中NO2的污染,
已知:①N(g)+2O2(g)=2NO2(g)ΔH=+133kJ/mol;②H2O(g)=H2O(1)ΔH=-44kJ/mol;③H2的燃烧热为285.8kJ/mol,该反应的热化学方程式为___________.
(3)CO2可在一定条件下转化为CH3OH。己知向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂和T1温度下,发生反应:CO2(g)+3H2(g) ![]() CH3OH(1)+H2O(1)ΔH<O,10min时达到平衡状态,10min后改变温度为T2,生成物全部为气体,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(1)+H2O(1)ΔH<O,10min时达到平衡状态,10min后改变温度为T2,生成物全部为气体,20min时达到平衡状态,反应过程中部分数据见表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
0min | 2 | 6 | 0 | 0 |
10min | 4.5 | |||
20min | 1 |
①前10min内的平均反应速率v(CO2)=_______,20min时H2的转化率为_______。
②在其他条件不变的情况下,若30min时只改变温度为T3,达平衡时H2的物质的量为3.2mol,则T2______T3(填“>”“<”或“=”),在温度T2时,反应的化学平衡常数为______。
③在T1温度下,将容器容积缩小一倍,反应达平衡时CH3OH物质的量为____mol.和改变下列条件,能使H2的反应速率和转化率都一定增大的是____(填标号)。
A.在容积不变下升高温度
B.其它条件下不变,增加压强
C.在容积和温度不变下充入N2
D.在容积和温度不变下及时分离出CH3OH
【答案】 BD 4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1100.2kJ/mol 0.025mol/(Lmin) 50% < 4/27 0.75 B
【解析】(1) A.CO2与水反应生成H2CO3,NO2与水反应生成HNO3和NO,HNO3为强酸,选项A错误;B.NO2具有氧化性,NH3具有还原性,两者在一定条件下能反应生成无污染的N2、H2O,选项B正确;C.由于物质的量浓度没有限定,无法根据两者的pH判断其酸性强弱,选项C错误;D.硫酸为强酸,能与弱酸盐Na2CO3反应生成CO2,选项D正确。答案选BD;(2)根据热化学方程式:①N2(g)+2O2(g)=2NO2(g)ΔH1=+133kJ/mol;②H2O(g)=H2O(1)ΔH2=-44kJ/mol;③H2的燃烧热为285.8kJ/mol:2H2(g)+O2(g)= 2H2O(1) ΔH3=-571.6kJ/mol;根据盖斯定律,由③×2-②×4-①可得反应:4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=ΔH3×2-ΔH2×4-ΔH1=-571.6kJ/mol×2-(-44kJ/mol)×4-(+133kJ/mol)=-1100.2kJ/mol;(3)①v(H2)= 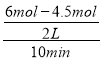 =0.075mol/(Lmin),速率之比等于化学计量数之比,v(CO2)=
=0.075mol/(Lmin),速率之比等于化学计量数之比,v(CO2)= ![]() v(H2)=
v(H2)= ![]() ×0.075mol/(Lmin)= 0.025mol/(Lmin);20min时消耗1molCO2,则消耗3molH2,H2的转化率=
×0.075mol/(Lmin)= 0.025mol/(Lmin);20min时消耗1molCO2,则消耗3molH2,H2的转化率=![]() ×100%=50%;②T2温度下平衡时氢气物质的量为3mol,在其他条件不变的情况下,若30min时只改变温度T3,达平衡时H2的物质的量为3.2mol,平衡逆向移动,氢气浓度增大,由于正反应为放热反应,可以升高温度,即T2<T3;20min时,转化的CO2为2mol-1mol=1mol,则生成的甲醇为1mol,
×100%=50%;②T2温度下平衡时氢气物质的量为3mol,在其他条件不变的情况下,若30min时只改变温度T3,达平衡时H2的物质的量为3.2mol,平衡逆向移动,氢气浓度增大,由于正反应为放热反应,可以升高温度,即T2<T3;20min时,转化的CO2为2mol-1mol=1mol,则生成的甲醇为1mol,
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L) 1 3 0 0
改变浓度(mol/L) 0.5 1.5 0.5 0.5
平衡浓度(mol/L) 0.5 1.5 0.5 0.5
故平衡常数K=![]() =
=![]() =
=![]() ;③T1温度下,生成物为液态,K=
;③T1温度下,生成物为液态,K=![]() 由于温度不变,K不变,容器容积缩小一倍,CO2浓度变为2mol/L、氢气浓度变为6mol/L,设此时达平衡时二氧化碳浓度为xmol/L,则:
由于温度不变,K不变,容器容积缩小一倍,CO2浓度变为2mol/L、氢气浓度变为6mol/L,设此时达平衡时二氧化碳浓度为xmol/L,则:
CO2(g)+3H2(g) ![]() CH3OH(1)+H2O(l)
CH3OH(1)+H2O(l)
起始浓度(mol/L) 2 6
改变浓度(mol/L) 2-x 6-3x
平衡浓度(mol/L) x 3x
则![]() =
=![]() ,解得x=0.75,生成甲醇物质的量为0.75mol;④A、升高温度,氢气的反应速率增大,但该反应放热,氢气的转化率减小,选项A错误;B、无论生成物是否是气体,增大压强反应速率和氢气的转化率都增大,选项B正确;C、充入氮气使体系压强增大,但是各种反应物的浓度并没有变化,碰撞几率依旧不变,所以平衡不移动,选项C错误;D、甲醇为液体时,分离出甲醇,对反应速率几乎无影响,选项D错误。答案选B。
,解得x=0.75,生成甲醇物质的量为0.75mol;④A、升高温度,氢气的反应速率增大,但该反应放热,氢气的转化率减小,选项A错误;B、无论生成物是否是气体,增大压强反应速率和氢气的转化率都增大,选项B正确;C、充入氮气使体系压强增大,但是各种反应物的浓度并没有变化,碰撞几率依旧不变,所以平衡不移动,选项C错误;D、甲醇为液体时,分离出甲醇,对反应速率几乎无影响,选项D错误。答案选B。