��Ŀ����
����Ŀ����1����һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ1��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
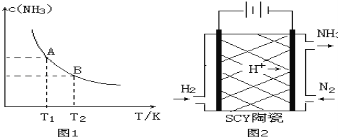
���¶���T1�仯��T2ʱ��ƽ�ⳣ����ϵK1 K2����������������������=������
���÷�Ӧ��T1�¶���5.00min�ﵽƽ�⣬���ʱ����N2�Ļ�ѧ��Ӧ����Ϊ ��
��T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1= ��
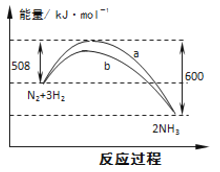
��2�������������˹��̵������о��������ڳ��³�ѹ����������N2�ڴ���������ˮ������Ӧ��2N2��g��+6H2O��l��=4NH3��g��+3O2��g�����˷�Ӧ����S 0����������������������
��N2��g��+3H2��g��=2NH3��g�� ��H=a kJ/mol
2H2��g��+O2��g��=2H2O��l�� ��H=b kJ/mol
2N2��g��+6H2O��l��=4NH3��g��+3O2��g������H= ���ú�a��b��ʽ�ӱ�ʾ����
��3����ѧ�Ҳ������Ӹߵ����Ե�SCY�մ����ɴ���H+��ʵ���˵��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��ԭ��ʾ��ͼ��ͼ2��ʾ���������ĵ缫��Ӧʽ�� ��
��4����֪ijЩ���������ˮ�еĵ���ƽ�ⳣ����25�������±���
������� | H2CO3 | NH3.H2O |
����ƽ�ⳣ�� | Ka1=4.30��10-7 Ka2=5.61��10-11 | Kb=1.77��10-5 |
���г�����0��1 mol��L-1����NH4��2CO3��Һ��
������Һ�� ��������������������������������ԭ���� ��
������NH4��2CO3��Һ�и���Ũ��֮��Ĺ�ϵʽ����ȷ���� ��
A��c��NH4+��>c��CO32-��>c��HCO3-��>c��NH3.H2O��
B��c��NH4+��+c��H+��=c��HCO3-��+c��OH-��+c��CO32-��
C��c��CO32-��+c��HCO3-��+c��H2CO3��=0.1mol/L
D��c��NH4+��+c��NH3.H2O��=2c��CO32-��+2c��HCO3-��+2c��H2CO3��
E��c��H+��+c��HCO3-��+c��H2CO3��=c��OH-��+c��NH3.H2O��
���𰸡���1����������8.00��10��3mol/��Lmin������K1��18.3��
��2��������2a��3b��kJ/mol����3��N2+6e��+6H+=2NH3��
��4���������NH3��H2O�ĵ���ƽ�ⳣ������HCO3-�ĵ���ƽ�ⳣ�������CO32-ˮ��̶ȴ���NH4+ˮ��̶�����Һ�ʼ������� BE��
��������
�����������1��������ͼ1�������¶ȵ����ߣ�NH3��Ũ�Ƚ��ͣ�������������ԭ��������Ӧ�����Ƿ��ȷ�Ӧ����ѧƽ�ⳣ�����¶ȵ�Ӱ�죬�����¶ȣ�ƽ��������Ӧ�����ƶ�����ѧƽ�ⳣ�����ͣ���K1>K2��
�� N2��3H2![]() 2NH3
2NH3
��ʼ�� 1 3 0
�仯�� x 3x 2x
ƽ�⣺1��x 3��3x 2x
2x/��4��2x����100%=25%�����x=0.4�����ݻ�ѧ��Ӧ���ʵĶ��壬v��N2��=0.4/��10��5��mol/��L��min��=8.00��10��3mol/��Lmin���������ݻ�ѧƽ�ⳣ���ı���ʽ��K=c2��NH3��/[c��N2����c3��H2��]��18.3����2����̬��Һ�������壬���Ҷ���������������Ӧ������ϵ��֮�ʹ��ڷ�Ӧǰ����˴˷�Ӧ�Ƿ���ʽ����S>0����N2��g��+3H2��g��=2NH3��g������2H2��g��+O2��g��=2H2O��l����2������3�����ó���H=��2a��3b��kJ��mol��1����3���ӵ�Դ������һ��Ϊ�������ӵ�Դ������һ��Ϊ�������ϳɰ��е������ϼ۽��ͣ��������ϵõ����ӣ����ݽṹʾ��ͼ�����������ԣ���˵缫��ӦʽΪ��N2+6e��+6H+=2NH3����4�������ݵ���ƽ�ⳣ�������Է���NH3��H2O�ĵ���ƽ�ⳣ������HCO3���ĵ���ƽ�ⳣ��������ˮ�����Խ��Խˮ�⣬CO32����ˮ��̶ȴ���NH4����ˮ�⣬���̼��淋�ˮ��Һ�Լ��ԣ���A��CO32����ˮ��̶ȴ���NH4����ˮ�⣬��Ũ�ȴ�С��c��NH4����>c��CO32����>c��HCO3����>c��NH3��H2O������˵����ȷ��B�����ݵ���غ㣬Ӧ�ǣ�c��NH4����+c��H���� = c��HCO3����+c��OH����+2c��CO32��������˵������C�����������غ㣬Ӧ��c��CO32����+c��HCO3����+c��H2CO3�� = 0.1mol��L��1����˵����ȷ��D�����������غ㣬��c��NH4����+c��NH3.H2O�� = 2c��CO32����+2c��HCO3����+2c��H2CO3������˵����ȷ��E�����������غ㣬c��H����+c��HCO3����+2c��H2CO3�� = c��OH����+c��NH3��H2O���� ��˵������

 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�