题目内容
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
| A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
C
解析试题分析:左边装置是氢氧燃料电池,电池放电时,燃料发生氧化反应,投放燃料的电极为负极,投放氧化剂的电极为正极,正极上发生还原反应,由于电解质溶液呈酸性,正极反应为:O2+4e-+4H+=2H2O;右边装置是电解池,连接负极的b电极是阴极,连接正极的a电极是阳极,阳极发生氧化反应,阴极发生还原反应;A、该燃料电池是在酸性电解质中工作,所以正极反应为:O2+4e-+4H+=2H2O,错误;B、a与电池正极相连,a为电解池的阳极,b与电池的负极相连,b为电解池的阴极,所以应该是a极的Fe溶解,b极上析出Cu,错误;C、a极是粗铜,b极是纯铜时,为铜的电解精炼,电解时,a极逐渐溶解,b极上有铜析出,正确;D、电解CuSO4溶液时,a极产生的气体为O2,产生1molO2需4mol电子,所以需要燃料电池的2molH2,二者的体积并不相等,错误。
考点:考查原电池和电解池知识

 智能训练练测考系列答案
智能训练练测考系列答案将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是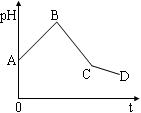
| A.阳极产物一定是Cl2,阴极产物一定是Cu |
| B.BC段表示在阴极上是H+放电产生了H2 |
| C.整个过程中阳极先产生Cl2,后产生O2 |
| D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+,故pH减小 |
下列叙述不正确的是( )
| A.铁表面镀锌,锌作阳极 |
| B.船底镶嵌锌块,锌作正极,以防船体被腐蚀 |
| C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH- |
| D.工业上电解饱和食盐水的 |
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是( )
| A.正极附近的SO42-离子浓度逐渐增大 |
| B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 |
| D.铜片上有H2逸出 |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是( )
| A.由TiO2制得1mol 金属Ti ,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为:C + 2O2-? 4e- ="=" CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极(已知铅蓄电池放电时的总反应为Pb + PbO2 + 2H2SO4= 2PbSO4 + 2H2O) |
在钢铁的电化腐蚀中,正极上发生的反应可能是
| A.Fe - 2e—=Fe2+ | B.O2+4e-+2H2O=4OH- |
| C.4OH- - 4e-=O2↑+2H2O | D.4Fe(OH)2+O2+2H2O =4Fe(OH)3 |
市场上经常见到的标记为Li-ion的电池。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为: Li+2Li0.35NiO2  2Li0.85NiO2,下列说法不正确的是( )
2Li0.85NiO2,下列说法不正确的是( )
| A.放电时,负极的电极反应式:Li-e-=Li+ |
| B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 |
| C.该电池既能用酸溶液又能用碱溶液作电解质溶液。 |
| D.放电过程中Li+向正极移动 |
用惰性电极电解50 mL锰酸钾溶液:K2MnO4+H2O→KMnO4+H2↑+KOH(未配平),当生成112 mL氢气(标准状况)时停止通电。下列判断正确的是 ( )
| A.K+浓度减小 | B.KMnO4在阳极区生成 |
| C.阴极周围溶液的pH减小 | D.反应过程中共转移0.005mol电子 |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |