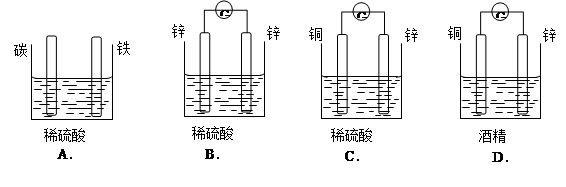
题目内容
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
D
解析试题分析:A、铁比铜的金属性强,故还原性也强,错误;B、当a、b连接后,铜作为正极,流入电子,发生反应,错误;C、因为铁的还原性强,失去电子,变成Fe离子,铜离子的氧化性强,得到电子,析出铜,溶液由蓝色变成浅绿色,错误;D、Cu2+向负极移动,而铜电极是正极,正确。
考点:考查氧化还原反应的知识点。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
| A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
2008年10月8日,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋科学天才奖”。下列叙述正确的是
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
| C.合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |
| D.铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e- = Fe3+,继而形成铁锈 |
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①:①③相连时,③为正极:②④相连时,②上有气泡逸出:③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
下列对金属及其制品的防护措施中,错误的是
| A.把Cr、Ni等金属加入到普通钢里制成不锈钢铁 |
| B.通过特殊工艺,增加铝制品表面的氧化膜 |
| C.对于易生锈的铁制品要定期刷防护漆 |
| D.锅用完后,用水刷去其表面的油污,置于潮湿处 |
用惰性电极在一定温度下电解某Na2SO4饱和溶液,当两极共产生标准状况下67.2L气体时,从溶液中析出64.4g Na2SO4?10H2O 晶体。则剩余溶液的溶质质量分数约是
| A.64.7% | B.47.5% | C.32.2% | D.28.3% |
用惰性电极进行电解,下列说法正确的是
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 |
下图是氢氧燃料电池构造示意图。下列说法不正确的是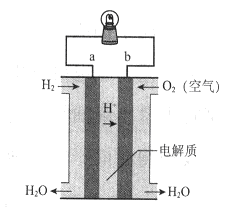
| A.a极是负极 |
| B.电子由b通过灯泡流向a |
| C.该电池总反应是2H2+ O2= 2H2O |
| D.该装置可将化学能转化为电能 |