题目内容
(Ⅰ)FeCl3的水溶液呈
实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以
(Ⅱ)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题: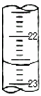
(1)某次滴定时的滴定管中的液面如图所示,其读数为
(2)根据下列数据:
请计算待测烧碱溶液的浓度为
(3)下列实验操作会使实验结果偏高的是
A、锥形瓶用待测液润洗后再注入待测液
B、酸式滴定管未用标准液润洗,便装入标准液
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
D、酸式滴定管滴定前有气泡,滴定后无气泡.
酸性
酸性
(填“酸性”、“碱性”或“中性”),原因是Fe3++3H2O?Fe(OH)3+3H+;
Fe3++3H2O?Fe(OH)3+3H+;
(用离子方程式表示);实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以
抑制
抑制
(填“促进”、“抑制”)其水解;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是Fe2O3
Fe2O3
.(Ⅱ)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:

(1)某次滴定时的滴定管中的液面如图所示,其读数为
22.60
22.60
mL.(2)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
0.1250
0.1250
mol/L.(3)下列实验操作会使实验结果偏高的是
A、B、C、D
A、B、C、D
.A、锥形瓶用待测液润洗后再注入待测液
B、酸式滴定管未用标准液润洗,便装入标准液
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
D、酸式滴定管滴定前有气泡,滴定后无气泡.
分析:(Ⅰ)FeCl3在水溶液中水解溶液呈酸性;实验室配制FeCl3的水溶液时,为了抑制三价铁离子水解,常将FeCl3固体先溶于较浓的盐酸中;FeCl3溶液加热促进水解,同时生成的HCl挥发,最后蒸干,灼烧,产物为:Fe2O3;
(Ⅱ)(1)读数时目光平视,凹液面最低点与刻度线相切.
(2)第一次酸为25.40-0.50=24.90mL,第二次酸为29.10-4.00=25.10mL,消耗酸为
=25.00mL,利用H+、OH-的物质的量相等来计算;
(3)根据根据c(待测)=
来分析;
(Ⅱ)(1)读数时目光平视,凹液面最低点与刻度线相切.
(2)第一次酸为25.40-0.50=24.90mL,第二次酸为29.10-4.00=25.10mL,消耗酸为
| 24.90mL+25.10mL |
| 2 |
(3)根据根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
解答:解:(Ⅰ)FeCl3在水溶液中水解溶液呈酸性,其水解离子方程式为:Fe3++3H2O?Fe(OH)3+3H+;实验室配制FeCl3的水溶液时,为了抑制三价铁离子水解,常将FeCl3固体先溶于较浓的盐酸中;FeCl3溶液加热促进水解,同时生成的HCl挥发,最后蒸干,灼烧,产物为:Fe2O3;
故答案为:酸性;Fe3++3H2O?Fe(OH)3+3H+;抑制;Fe2O3
(Ⅱ)(1)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60,
故答案为:22.60.
(2)第一次酸为25.42-0.52=24.90mL,第二次酸为29.17-4.07=25.10mL,消耗酸为消耗酸为
=25.00mL,
由酸碱中和的实质可知,25.00mL×0.001L/mL×0.1000mol?L-1=20.00mL×0.001L/mL×c(碱),解得c(碱)=0.1250mol/L,
故答案为:0.1250mol/L;
(3)A、锥形瓶用待测液润洗后再注入待测液,消耗标准溶液偏多,所以结果偏高;
B、酸式滴定管未用标准液润洗,便装入标准液,标准溶液浓度偏小,所以消耗标准溶液偏多,所以结果偏高;
C、酸式滴定管滴定前俯视读数,滴定后仰视读数,所以消耗标准溶液偏多,所以结果偏高
D、酸式滴定管滴定前有气泡,滴定后无气泡,所以消耗标准溶液偏多,所以结果偏高,
故答案为:A、B、C、D.
故答案为:酸性;Fe3++3H2O?Fe(OH)3+3H+;抑制;Fe2O3
(Ⅱ)(1)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60,
故答案为:22.60.
(2)第一次酸为25.42-0.52=24.90mL,第二次酸为29.17-4.07=25.10mL,消耗酸为消耗酸为
| 24.90mL+25.10mL |
| 2 |
由酸碱中和的实质可知,25.00mL×0.001L/mL×0.1000mol?L-1=20.00mL×0.001L/mL×c(碱),解得c(碱)=0.1250mol/L,
故答案为:0.1250mol/L;
(3)A、锥形瓶用待测液润洗后再注入待测液,消耗标准溶液偏多,所以结果偏高;
B、酸式滴定管未用标准液润洗,便装入标准液,标准溶液浓度偏小,所以消耗标准溶液偏多,所以结果偏高;
C、酸式滴定管滴定前俯视读数,滴定后仰视读数,所以消耗标准溶液偏多,所以结果偏高
D、酸式滴定管滴定前有气泡,滴定后无气泡,所以消耗标准溶液偏多,所以结果偏高,
故答案为:A、B、C、D.
点评:本题考查了盐类水解,酸碱中和滴定,明确中和滴定实验的仪器、步骤、指示剂的选择、数据处理等即可解答,注意滴定管的读数为易错点,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目


 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3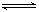 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式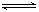 HSO3-+OH-
HSO3-+OH-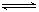 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是 Fe(OH)3胶体+3HCl
Fe(OH)3胶体+3HCl